Бейтса
Cтраница 4
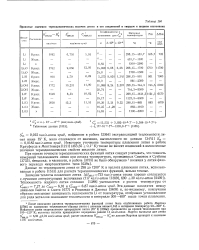 |
Принятые значения термодинамических величин лития и его соединений в твердом и жидком состояниях. [46] |
Теплоемкость жидкого лития согласно [1389] уменьшается с ростом температуры от Ср45з 7 7 27 до Ср6об 6 91 и Ср120о 6 87 кал / г-атом - град. Эти данные находятся между данными Бейтса и Смита [677] и Редмонда и Джонса [3409] и, по-видимому, наилучшим образом описывают зависимость теплоемкости Li от температуры, отображая установленное для ряда металлов понижение теплоемкости в интервале 300 - 400 выше точки плавления. [47]
Таким образом, и после цитированной работы Бейтса и Алфенаара [82] проблема построения таких шкал ионной активности, которые позволяли бы приписывать получаемым на их основе величинам достаточно ясный физический смысл в области умеренно и сильно концентрированных растворов, не потеряла своей актуальности. Это, по-видимому, и побудило Бейтса совместно с Робинсоном и другими соавторами предложить в серии публикаций [23, 84-86] новый подход к решению этой проблемы, основанный на теории гидратации ионов Сток-са - Робинсона [ 22, гл. [48]
Эти предположения не соответствуют теории Сток-са и Робинсона, в которой аддитивности чисел гидратации не предполагается: напротив, значение Л ( - данного иона считается зависимым от природы другого иона в электролите. И, наконец, в гидратной теории Бейтса - Робинсона делается предположение о постоянстве для электролита и ионов параметров уравнения А, В и а, что в общем случае не выполняется, так как величины микроскопической диэлектрической проницаемости вблизи катиона и аниона могут быть не одинаковыми. Это особенно существенно для электролитов, состоящих из ионов, сильно различающихся по своим кристаллографическим радиусам или зарядам. [49]
Фридмен переехал в С Франциско. Помимо Нобелевской премии, он удостоен медали Дж Бейтса Кларка Американской экономической ассоциации в 1951 г., четных ученых степеней многих американских и зарубежных универс тов и колледжей. [50]
Зная значения Д ( определенные одним из методов) и экспериментальные величины у, по уравнению ( V. С индивидуальные коэффициенты активности ионов и сопоставил их с данными работы Бейтса и Робинсона, приведенными в табл. V. [51]
Этот метод является обобщением метода Бейтса и Дамгаард ( см. § 33) на переходы в состояния непрерывного спектра. Радиальная функция дискретного спектра Rnl определяется точно таким же образом, как и в методе Бейтса, Дамгаард. [52]
Бейтса - Робинсона будет приводить к корректным результатам в сравнительно широком интервале концентраций. В случае же электролитов, ионы которых обладают неодинаковыми по абсолютной величине зарядами или заметно различаются по размерам, расчет по Бейтсу - Робинсону может дать удовлетворительные результаты только в области достаточно разбавленных растворов; в таких растворах ионы находятся на сравнительно больших расстояниях друг от друга, так что усредненная диэлектрическая проницаемость межионной среды мало отличается от диэлектрической проницаемости свободной воды. [53]
Хотя за 1920 - 1940 гг. был разработан ряд экспериментальных и вычислительных методов для определения констант устойчивости, исследования систем, содержащих несколько комплексов, были немногочисленны. Некоторые из лучших работ такого рода касались полиосновных кислот [6, 42, 51, 69, 74]; заслуживают внимания такие исследования комплексов металлов, как работы Меллера [46] по тиоцианату железа ( III), Бейтса и Восбурга [8] по иодиду кадмия, Рилея и его сотрудников [29, 30, 62, 63], которые изучали главным образом комплексы меди ( II) и кадмия. Стимулом к дальнейшим исследованиям послужило то, что в 1941 г. появились общие методы расчета ступенчатых констант устойчивости на основе экспериментальных функций п ( а) и ао ( а), описанные Я. [54]
 |
Химические коэффициенты активности ионов Са2 и СГ в водных растворах хлорида кальция при 25 С. [55] |
Можно с уверенностью утверждать, что небольшие по размерам двухзарядные ионы Mg2 и Са2 оказывают гораздо более сильное воздействие на окружающую их воду, чем сравнительно крупный однозарядный хлорид-ион. Эти различия выразятся не только в существенном изменении диэлектрической проницаемости воды вблизи катионов Mg2 и Са2, что уже само по себе ставит под сомнение возможность применения расчетных формул метода Бейтса - Робинсона ( см. разд. Кроме того, в случае таких сильно гидратирующихся ионов, как Mg2 и Са2, постулат теории Стокса - Робинсона о постоянстве числа гидратации электролита, вероятно, нарушается уже при сравнительно умеренных концентрациях соответствующей соли. [56]
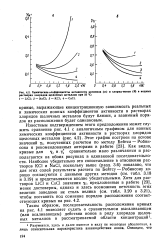 |
Химические коэффициенты активности катионов ( а и хлорид-ионов ( в в водных растворах хлоридов щелочных металлов при 25 С. 1 - LiCl. 2 - NaCl. 3 - КС.. 4 - CsCl. [57] |
Как видно, кривые для Y4 и - Yj сравнительно мало различаются и располагаются на обоих рисунках в одинаковой последовательности. Наиболее убедительно это сопоставление в отношении растворов КС1 и NaCl, поскольку выше ( разд. Бейтсу - Робинсону хорошо согласуются с данными других методов ( см. табл. 3.18 и 3.19) и представляются вполне убедительными. [58]
Пундзак ( Pundsack, 1956), изучая плотность хризотила, пришел к выводу, что у массивных волокнистых образцов эта плотность значительно ниже теоретической, рассчитанной на основании представления о трубчатом строении волокон. Он считает поэтому, что волокна хризотила не являются трубчатыми. По мнению Бейтса, значения плотности образцов хризотила, полученные Пундзаком и Калоузеком ( Kalousek, Muttart, 1957), соответствуют величинам, которые устанавливаются на основании морфологических данных детализированной структуры. Присутствие плохо ориентированного материала внутри трубок и между ними объясняет причину того, что измеренная плотность образцов хризотила не совпадает с рассчитанной плотностью гипотетического образца, состоящего из правильных плотно упакованных полых трубок. [59]
Бейтс и Дамгард [18] разработали приближенный метод расчета вероятностей переходов, пригодный для одновалентных и двухвалентных атомов и нашедший широкое применение. Колесников и Слепченко [21] по методу Бейтса и Дамгард рассчитали вероятности переходов линий Ва. Ball и, сопоставив результаты расчета со своими экспериментальными данными, установили удовлетворительное соответствие теории и эксперимента, что даже вызывает некоторое удивление, так как метод Бейтса и Дамгард по существу должен быть хорошо применим для легких щелочных и щелочноземельных элементов, но отнюдь не для такого тяжелого элемента, как барий. [60]
Страницы: 1 2 3 4 5