Другие белок
Cтраница 3
 |
Формы отдельных участков цепи макромолекул белка при различных значениях рН. [31] |
На поверхности тех и других белков имеется большое количество гидрофильных групп, которые обусловливают создание вокруг этих макроструктур почти сплошной водной оболочки. Гидрофобные радикалы аминокислот, образующие полипептидные цепи, обращены преимущественно внутрь структуры. Несмотря на это, некоторое количество воды может быть связано и внутри белковых макроструктур. Часть гидрофильных групп может содержаться и во внутренних отделах белковых макроструктур; кроме того, некоторая часть воды может быть замкнута внутри этих структур в своеобразных ячейках, образованных гид-ратированными полипептидными цепочками. И, наконец, диполи воды могут попросту вклиниваться в водородные связи, не нарушая при этом их прочности. Принято различать интермицеллярную воду, находящуюся в свободном состоянии между отдельными белковыми макромолекулами, и интрамицелляр-ную воду, находящуюся внутри белковых глобул. [32]
Глобин отличается от большинства других белков высоким содержанием гистидина ( см. табл. 1), количество которого в разных препаратах глобина достигает 6 - 10 % по сравнению с 2 - 3 % в большинстве других белков. Нативный глобин растворим в широких пределах рН, денатурированный же глобин выпадает в осадок при слабой щелочной реакции; этим можно воспользоваться для отделения денатурированного глобина от нативного. [33]
Глобулины, подобно большинству других белков, также можно осаждать из раствора методом высаливания. Такое осаждение может быть полезным в качестве предварительной стадии фракционирования или концентрирования растворов белков. [34]
Точно такие же аминокислоты других белков жертвы не используются возбудителями малярии. Однако ферменты плазмодиев действуют лишь в том случае, если гемоглобин имеет строго определенную структуру. Например, известны малярийные плазмодии, паразитирующие на представителях некоторых видов птиц, рептилий, млекопитающих, поскольку способны питаться только их гемоглобином. Гемоглобин, имеющий иную молекулярную структуру, незнакомую ферментным системам таких плазмодиев, для них не приемлем. [35]
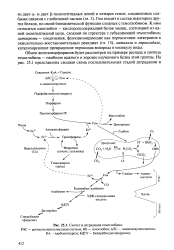 |
Синтез и деградация гемоглобина. [36] |
Гем входит в состав некоторых других белков, по своей биохимической функции сходных с гемоглобином. К ним относится миоглобин - кислородсодержащий белок мышц, состоящий из одной полипептидной цепи, сходной по структуре с субъединицей гемоглобина; цитохромы - соединения, функционирующие как переносчики электронов в окислительно-восстановительных реакциях ( гл. [37]
В кровеносной системе имеются и некоторые другие белки, обеспечивающие транспорт определенных компонентов по организму, например трансферрин, являющийся переносчиком ионов железа, и церулоплазмин - переносчик ионов меди. [38]
Как известно, лизоцим отличается от других белков своей относительной стабильностью к нагреванию вплоть до 100 С. При нагревании до 60 С резко возрастают все реологические характеристики слоя, особенно модуль медленной эластической деформации и вязкость эластичности. Кривые развития равновесного напряжения сдвига Ps ( т) также характеризуются большими значениями пределов прочности структуры слоя Prs и значениями напряжений сдвига, поддерживающих стационарное течение Pss. Время достижения стационарности увеличивается с повышением температуры от 300 до 480 сек. [39]
Нитевидный комплекс ДНК, гисто-нов и других белков, составляющий основу эукариотических хромосом. [40]
 |
Изоэлектрические точки некоторых белков. [41] |
Подобно желатину, и в отношении других белков мы можем говорить об определенном ( для каждого белка различном) значении рН, при котором этот белок будет находиться в изоэлект-рическом состоянии. Это вначение рН называется изоэлектриче-ской точкой белка. [42]
Далее был найден состав и некоторых других белков. Например, уже известно строение гормонов, вырабатываемых гипофизом человека и животных - кортикотропина, состоящего из 39 аминокислот, и меланотропина, имеющего в своем составе 18 аминокислот. О них позже мы расскажем более подробно. [43]
Синтез ферментов, как и всех других белков, идет на рибосомах из свободных аминокислот. Концентрация различных ферментов в клетке не является постоянной величиной. Их количество можно тысячекратно увеличить путем индукции, которую вызывают добавлением в среду субстрата. Внесение мальтозы в среду выращивания хлебопекарных дрожжей вызывает, например, увеличение содержания фермента мальтазы в клетках дрожжей. [44]
Синтез структурных белков отличается от образования других белков хлоропластов. Это свидетельствует или о том, что в хлоропластах имеется два вида систем синтеза белка, одна из которых сходна с митохондриальной ( образование структурных белков), или о том, что структурные белки образуются вне хлоропластов, а затем диффундируют и встраиваются в них. Этот вопрос сейчас интенсивно исследуется в нескольких лабораториях, что позволяет надеяться на быструю его расшифровку. [45]
Страницы: 1 2 3 4