Денатурированные белок
Cтраница 3
Они предотвращают кислотную денатурацию белков и восстанавливают конформацию уже денатурированных белков. [31]
В настоящее время это делают, оценивая вращение полностью денатурированных белков, чтобы выразить вращение, обусловленное остатками аминокислот. При этом предполагают, что определенное таким образом вращение не изменяется при закручивании полипептидной цепи в спираль. [32]
Развертывание пептидных цепей при денатурации подтверждается тем, что денатурированные белки дают более интенсивные цветные реакции, чем нативные белки. [33]
 |
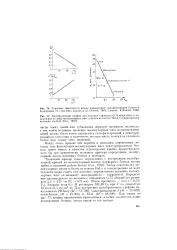
Кривые АДОВ ( сплошные линии. [34] |
Величина о находится из данных по дисперсии вращения для денатурированных белков. Таким образом, значение ха определяется двумя независимыми способами. Следует отметить, что присутствие ароматических остатков заметно влияет на значения констант в уравнении Моффита. [35]
Мы применили этот метод для анализа данных по диффузии денатурированных белков в смеси 6М гуанидин-гидрохлорид / ОДМ MSH [26] и получили a 9 7 А; для полистироль-ных фракций в тетрагидрофуране получено а 5 6 А. Каждое из значений а находится в хорошем соответствии с более ранними экспериментальными i и теоретическими данными. Преимущество метода КРЛС для определения невозмущенных размеров, вычисляемых по гидродинамическим теориям, приводящим к уравнениям ( 50) и ( 53), по сравнению с традиционными методами заключается в большем удобстве и точности. [36]
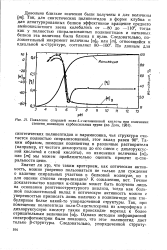 |
Плавление спиралей поли -. - глютаминовой кислоты при изменении степени ионизации карбоксильных групп ( по Доти, 1961. [37] |
Так, для синтетических полипептидов в форме клубка и для денатурированных белков эффективное вращение среднего аминокислотного звена колебалось от - 80 до - 110, тогда как у полностью спирализованных полипептидов и нативных белков эта величина была близка к нулю. [38]
Это мнение трудно проверить экспериментально, поскольку лишь немногие свойства денатурированных белков поддаются количественному измерению. Нерастворимость денатурированного белка не может быть использована как критерий денатурации, так как коагулят нерастворимого денатурированного белка может адсорбировать молекулы нативного белка и, наоборот, само свертывание денатурированного белка может тормозиться благодаря защитному действию остающегося в растворе нативного белка. [39]
В отличие от других типов ионообменника, которые весьма прочно связывают денатурированные белки, сферическая ДЭАЭ-цел-люлоза обладает меньшей абсорбционной способностью и благодаря этому ее можно регенерировать в колонке. [40]
Известно, что нативные белки обладают гораздо меньшим отрицательным вращением, чем денатурированные белки. Это позволило предположить, что такие изменения во вращении связаны с потерей спираль-ности. Уравнение, выражающее свойства ДОВ а-спи-ральных полипептидов, было использовано в качестве основы для оценки содержания се-спиралей во многих типах синтетических полипептидов и белков. Рассмотрение этой проблемы с теоретической точки зрения допускает связывание экситонов и показывает, что сильные эффекты Коттона противоположных знаков ( куплет) должны возникать в результате каждого сильного электронного перехода, такого, как п - я-переход при 190 нм. Позднее показано, что для неопределенно длинной спирали они вызывают появление другого куплета. Такой более точный подход с точки зрения экситонной теории позволяет предсказать четыре полосы для каждого сильного поглощения. Для а-спирали их появление ожидается при 185, 189 и 193 нм. Кроме того, как показано в разд. [41]
Для того чтобы охарактеризовать в какой-либо степени природу денатурационного превращения и описать свойства денатурированных белков, необходимо перечислить те характерные изменения, которые возникают как результат денатурации протеинов. Можно назвать не менее семи признаков денатурации: 1) уменьшение растворимости белка, точнее - повышение способности осаждаться ( или высаливаться) при изоэлектрической реакции среды; 2) потеря специфической биологической активности ( например, ферментной); 3) повышение химической реактивности различных функциональных групп ( например, сульф-гидрильных, дисульфидных, кислотных, основных, фенольных гидроксилов и др.); 4) повышение расщепляемое белка про-теолитическими ферментами; 5) повышение вязкости растворов белка ( изменение формы и размеров его молекул); 6) повышение абсолютной величины отрицательного оптического вращения; 7) повышение коэффициента преломления растворов; 8) потеря способности к кристаллизации. [42]
Ввиду этого, прежде чем перейти к описанию определения методом гель-фильтрации молекулярных масс денатурированных белков, имеет смысл в качестве иллюстрации кратко процитировать хотя бы три практически полезных примера определения молекулярной массы нативных белков и пептидов. [44]
Предохранение от постденатурационной агрегации, кажущуюся, или внешнюю, стабилизацию, когда растворы денатурированных белков сохраняются прозрачными и как бы неизменными, можно вызвать действием: а) анионов жирных кислот и детергентов ( при больших их концентрациях); б) формальдегида; в) сульфгидрильных реагентов, йодуксусной кислоты; г) солей тимонуклеиновой кислоты. [45]
Страницы: 1 2 3 4