Нативного белок
Cтраница 1
Структура нативного белка должна отвечать за поддержание лактонной конформацин, а при денатурации должен образовываться аиилфермент с эфирной связью, находящейся в нормальной гранг-коифигурации. [1]
Свойства нативного белка, в частности его биологическая активность, требуют строго определенного, уникального пространственного расположения и конфигурации полипептидных цепочек. [2]
Полипептидная цепь нативного белка, свернутая и скрепленная внутримолекулярными дисульфид-ными мостиками, развертывается в результате восстановительного разрушения этих мостиков в 8 М мочевине с добавлением ( 3-меркаптоэтанола. [3]
Дисперсия оптического вращения нативного белка простая [126-128] и приводит к сильному отрицательному эффекту Коттона не при 225 или 190 ммк, а при 203 ммк. Таким образом, два главных типа спиралей характеризуются качественно различными вращательными свойствами. [4]
Намеченный здесь путь определения массы нативного белка не прост, особенно в том случае, когда константа седиментации белка неизвестна. Кроме того, даже и он не гарантирует высокой точности результатов. Наконец, маркерные белки часто гетерогенньт по величине а, и пользоваться литературными данными здесь следует с большой осторожностью. [5]
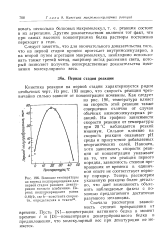 |
Влияние температуры на период полупревращения для первой стадии реакции денатурации яичного альбумина. Период полупревращения равен. [6] |
Пусть [ N ] - концентрация нативного белка в момент времени t и [ D ] - концентрация денатурированного белка в предположении, что молекулярный вес при денатурации не меняется. [7]
Определяя положение и интенсивность дифракционных максимумов ( для нативного белка и для соответствующего числа его изоморфных производных), можно в принципе вывести из этих данных структуру интересующего нас белка. Для получения высокого разрешения требуется провести измерения на очень большом числе дифракционных максимумов. [8]
Определение концевых групп можно рассматривать как метод анализа нативного белка, так как в первой основной стадии реагирует нативный белок. При этом предполагается, что условия проведения этой реакции таковы, что разрушения белка не происходит. [9]
Еопрос о том, является ли набор пространственных структур нативного белка и соответственно фермента, построенного с его участием, термодинамически устойчивым при данных условиях, широко обсуждается в современной биохимической литературе. Но если взять фермент в процессе проведения им химического превращения, идущего почти всегда с падением свободной и полной энергии системы, то трудно представить механизм такого быстрого рассеяния энергии, чтобы молекула фермента, интенсивно работающего в потоке энергии, сохранилась на первоначальном уровне термодинамической устойчивости. Захват энергии реакции белковой мицелой в форме ее некоторого нетеплового возбуждения ( экситонного, резонансного, электронного), предполагаемый в изложенной выше теории рекуперации энергии при катализе, представляется неизбежным. Он должен выводить фермент из термодинамически устойчивого состояния и тем повышать его каталитическую активность вследствие увеличения фазового объема и возникновения отсюда новых структурных и энергетических возможностей. [10]
Высказывалось предположение, что эти циклические соединения входят в состав молекулы нативного белка. Подобные соединения, однако, получаются и при нагревании аминокислот. [11]
Поскольку на пролин карбоксипептидаза не действует, после отщепления остатков треонина и аланина от нативного белка ВТМ действие фермента прекращается. В нитритных же мутантах действие карбоксипептидазы продолжается и после отщепления второго остатка, так как за ним следует лейцин. Эта замена, вероятно, происходит в результате превращения цитозина в урацил на каком-то из участков цепи РНК, содержащей 6000 оснований. Анализ показал, что изменение даже одного основания может привести к мутации. [12]
И тем не менее, в тех случаях, когда нужно хотя бы приближенно оценить молекулярную массу нативного белка, например состоящего из нескольких субъединиц или полипептидных цепей, метод гель-фильтрации, даже в упрощенном варианте калибровки по массам, оказывается весьма полезным. [13]
Для выполнения своей биологической функции необходимо, чтобы определенные группы соответствующим образом ориентировались и располагались в складках нативного белка. Идентичность прочих аминокислотных остатков может и не играть существенной роли и может зависеть от окружающих клетку условий в момент синтеза. Тот факт, что состав белков остается более или менее постоянным, скорее может являться результатом постоянства окружающей среды, чем доказательством того, что белки представляют собой соединения с постоянным составом. [14]
Температурная зависимость плотности сухих образцов натив-ного и очищенного эластина приведена на рис. 13.1. В диапазоне исследованных температур плотность нативного белка выше, чем очищенного. Типичные значения равны соответственно 1 245 и 1 232 г / мл при 25 С. В первом приближении это различие в плотностях можно объяснить различным составом нативного и очищенного белков. [15]
Страницы: 1 2 3 4