Нативного белок
Cтраница 3
Этот ориентирующий эффект ограничивает свободу вращения и поступательного движения молекул воды и, следовательно, ведет к уменьшению энтропии. Если же углеводородные остатки скрыты внутри молекулы нативного белка, то такая структурированная оболочка из молекул растворителя практически отсутствует. Следовательно, образование неполярных связей в значительной степени обусловлено тем, что переход неполярных остатков из водной среды в безводную сопровождается повышением энтропии. [31]
Поскольку в ковалентном остове полипептидной цепи все связи одинарные, можно было бы ожидать, что полипеп-тйд способен принимать в пространстве бесконечное число конформации. Более того, естественно было бы предположить, что конформация полипептида претерпевает постоянные изменения вследствие теплового движения и беспорядочного вращения участков цепи вокруг каждой из одинарных связей кова-лентного остова. Поэтому может показаться парадоксальным тот факт, что полипептидная цепь нативного белка в нормальных биологических условиях-при обычной температуре и нейтральных значениях рН - имеет только одну или очень небольшое число конформации. Эта нативная конформация достаточно устойчива: если выделение белка вести осторожно, избегая воздействий, приводящих к развертыванию цепей и денатурации, то выделенный белок может полностью сохранить свою биологическую активность. Это свидетельствует о том, что вокруг одинарных связей полипептидного остова в нативных белках свободное вращение невозможно. [33]
Как правило, реконструированные частицы, получаемые путем объединения белковой оболочки с вирусной РНК, обработанной азотистой кислотой, не обладают инфекционной способностью. Следовательно, в большинстве случаев дезаминирование оснований под действием азотистой кислоты приводит к летальным мутациям. В некоторых случаях мутации не летальны и белок мутантного вируса отличается от нативного белка по аминокислотному составу. Например, известен нитритный мутант, у которого на местах, занятых в нативном вирусе пролином, аспарагиновой кислотой и треонином, находятся соответственно лейцин, аланин и серии. В белке ВТМ С-концевая последовательность аминокислотных остатков имеет вид: - Гли-Про - Ала-Тре. Протеолитический фермент карбоксипептидаза отщепляет от С-конца при каждом акте отщепления одну аминокислоту. [34]
Возможно, чтр при де.на. тур ащш - пройсходйт-вза ТШидейсгвие карбоксильных и. Предполагают появление в белке при его денатурации некоторых новых радикалов, не характерных для нативного белка. Исследование при помощи рентгеновских лучей показало, что денатурированные белки отличаются от нативных более ясно выраженной кристаллической структурой. У глобулярных белков намечается переход к волокнистому строению. Этим объясняют наблюдающееся повышение вязкости белковых золей при денатурации их. [35]
Ответ довольно прост: помимолервияной стр ук-турь 1 белки збладают более высокими уровнями структурной организации. Если пояснить эту мысль коротко, то можно сказать, что ковалентно связанная полипептидная цепь нативного белка свертывается в пространстве определенным образом вследствие чего возни-кает характерная для данного типа белка укладка полипептидной цепи. [37]
Эти дифракционные методы до настоящего времени являются единственным способом изучения локализации молекул воды на поверхности и внутри белка. Они изобилуют ошибками, и данные часто неправильно интерпретируют даже тогда, когда экспериментальная работа выполнена тщательно. Фин-ней [23] недавно сделал исчерпывающий и ясный обзор данных в этой области, подчеркнув факторы, влияющие на стабильность или нестабильность структуры нативного белка и роль воды в стабилизации структуры. [38]
Известен также химический аналог превращения гемов в биливердин; его называют сопряженным окислением, и процесс состоит в окислении ( обычно кислородом или пероксидом водорода) Fe ( П) - порфирина в присутствии мягких восстановителей типа аскорбиновой кислоты или гидразина. Восстановитель поддерживает двухвалентное состояние железа и восстанавливает кислород ( если он взят как окислитель) до перок-сида водорода. Если гемопротеины денатурировать, а затем провести сопряженное окисление, возникает хаотическая смесь всех четырех биливердинов, и это говорит о каком-то направляющем действии нативного белка на расщепление тема. [39]
Характерной особенностью биологически активных белков является л гУпгтьг с. При этом происходит денатурация белка [102] с полной утратой его, биологической активности. Денатурация, которая, как правило, является необратимым процессом, представляет собой скорее фи зическую или внутримолекулярную перегруппировку, чем химическое изменение структуры нативного белка; она меняет специфическую пространственную конформацию макромолекулы / но не сопровЪждается гидролизом ковалентных связей. В живых организмах эта конформация возникает в результате взаимодействия боковых ответвлений полипептидных цепей, являясь термодинамически неравновесной; во время денатурации белок переходит в равновесную денатурированную форму. При достаточно сильном воздействии ферментов, тепла и различных химических агентов могут все же произойти более глубокие изменения вплоть до расщепления макромолекулы на отдельные аминокислоты вследствие гидролиза по пептидным связям. [40]
Он имеет слишком неопределенный характер, отражает неодинаковые, разнотипные изменения в белках и его целесообразнее заменять определением конкретных химических или физико-химических превращений, которые происходят в белковой молекуле. Принято считать, что денатурация представляет собой изменение макроструктуры белка - внутримолекулярную перегруппировку, переукладку структурных звеньев белковой частицы, связанную с изменением определенных свойств исходного нативного белка. По определению Козмана, денатурация - процесс ( или последовательность процессов), изменяющий пространственное расположение полипептидной цепи внутри молекулы белка от такого, которое характерно для нативного белка до более беспорядочного. Процесс этот совершается таким образом, что нативная структура разрушается, вероятно, сразу во всей молекуле или в большей ее части. Считают, что денатурационное превращение большинства глобулярных белков происходит, если не скачкообразно ( по принципу все или ничего), то во всяком случае проходя через небольшое число стадий. [41]
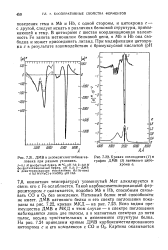 |
Кривая поглощения ( 1 и график ДМВ ( 2 нативного цитохрома с. [42] |
Мет алкилируется и связь его с Fe ослабляется. Такой карбоксиметилированный фер-роцитохром с оказывается, подобно Mb и НЬ, способным связывать СО и 02 без окисления. Нативный белок этой способности не имеет. ДМВ нативного белка и его спектр поглощения показаны на рис. 7.22, кривая МКД - на рис. 7.23. Ясно видны преимущества ДМВ и МКД в этом случае - в спектре поглощения наблюдаются лишь две полосы, а в магнитных спектрах до пяти полос, весьма чувствительных к изменениям структуры белка. [43]
У беспозвоночных вместо хорошо известного гемоглобина роль переносчиков кислорода часто выполняют пигменты негемовой природы - гемэритрин и гемоцианин. Несмотря на сходство функций всех трех названных белков, они сильно отличаются между собой по молекулярной структуре и химической природе активного центра, ответственного за перенос кислорода. Некоторые характерные свойства этих белков даны в табл. 11.1. Как в гемоглобине, так и в гемэритрине кислород связывается атомом железа, однако-в последнем ( а также и в гемоцианине) отсутствует гемовая группировка, несмотря на то, что в самих терминах содержится корень гем. Молекулярная масса и число субъединиц, входящих в макромолекулу нативного белка, тоже существенно разнятся для двух указанных белков. И все же, несмотря на эти различия, и гемоглобин, и гемэритрин с одинаковым успехом выполняют роль переносчиков кислорода. На этом примере было бы интересно проследить, до какой же степени можно варьировать строение молекулы без нарушения ее функций как переносчика кислорода. [44]
Величина тангенса угла наклона полученной прямой соответствует коэффициенту удерживания KR - Точка пересечения с осью ординат характеризует относительную свободную подвижность YQ. Эти два параметра определяют соответственно размер молекулы и ее суммарный заряд. У / Сд-R описывается прямой. При электрофорезе вполиакриламидном геле в присутствии додецилсульфата натрия определяют молекулярную массу диссоциированных субъединиц, а не нативного белка. Отсюда следует, что число субъединиц в молекуле белка можно оценить, сопоставляя данные электрофореза в полиакриламидном геле в присутствии и в отсутствие додецилсульфата натрия. [45]
Страницы: 1 2 3 4

