Нативного белок
Cтраница 4
Во многих случаях под влиянием различных физических и химических агентов происходит свертывание белковых растворов с образованием осадков, неспособных более к обратному растворению. Такой белок называется денатурированным белком. Денатурация является характерным свойством белков. Имеющиеся экспериментальные данные указывают на то, что в основе денатурации лежат физические или физико-химические внутримолекулярные изменения нативного белка, ведущие к потере специфической конфигурации белковой молекулы. [46]
Одно время считали, что роль матрицы, с которой соединяются молекулы аминоацил - РНК и на которой происходит сборка белковой молекулы, играет стабильная рибосомная РНК. Однако нуклеотидный состав ДНК очень слабо коррелирует с нуклеотидным составом рибосомной РНК. Кроме того, известно, что если какой-либо ген поврежден, бактерии теряют способность синтезировать белок. И, наконец, при включении необычных оснований в ДНК сразу начинает синтезироваться измененный белок, а синтез нативного белка прекращается. Хотя эти данные не позволяют еще решить вопрос окончательно, однако они указывают на трудности, возникающие при принятии гипотезы о том, что роль матрицы играет стабильная рибосомная РНК. [47]
Известен также химический аналог превращения гемов в биливердин; его называют сопряженным окислением, и процесс состоит в окислении ( обычно кислородом или пероксидом водорода) Fe ( П) - порфирина в присутствии мягких восстановителей типа аскорбиновой кислоты или гидразина. Восстановитель поддерживает двухвалентное состояние железа и восстанавливает кислород ( если он взят как окислитель) до перок-сида водорода. Если же в сопряженное окисление ввести миоглобин, то образуется биливердин - IXa; гемоглобин дает смесь, состоящую из продуктов - IXa и - IXp. Если гемопротеины денатурировать, а затем провести сопряженное окисление, возникает хаотическая смесь всех четырех биливердинов, и это говорит о каком-то направляющем действии нативного белка на расщепление тема. [48]
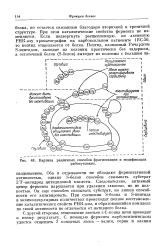 |
Картина различных способов фрагментации и модификации. [49] |
Оба в отдельности не обладают ферментативной активностью, однако S-белок способен связывать субстрат 2 3 -ангидрид нитидиловой кислоты. Следовательно, активный центр фермента нарушается при удалении хвоста, но не полностью. Он еще способен связывать субстрат, но лишен способности его активировать. При смешении S-белка и S-пептида в эквимолекулярных количествах происходит полное восстановление каталитических свойств РНК-азы, и образовавшийея комплекс по своей активности не отличается от нативного белка. [50]
 |
Высаливание карбоксигемоглобина фосфатом в зависимости от ионной силы раствора при значениях рН выше и ниже минимальной растворимости карбоксигемоглобина. [51] |
Тот факт, что нет необходимости учитывать взаимодействия с заряженными группами для объяснения влияния концентрированных растворов солей на денатурацию белков, становится наиболее очевидным при рассмотрении плавления желатинового геля, которое представляет собой одну из форм денатурации. И 7, хотя при предельных значениях рН все карбоксильные и амино-группы соответственно переходят в незаряженную форму. Очевидно, взаимодействие солей в концентрированном растворе с незаряженными участками полимеров способно вызывать изменения в его физическом состоянии. Неудивительно, что взаимодействия с заряженными группами играют незначительную роль в денатурации белков при нейтральных значениях рН, так как заряженные группы обычно находятся в контакте с растворителем на поверхности глобулы нативного белка, вследствие чего они могут взаимодействовать с солями одинаковым образом как в натив-ном, так и в денатурированном состояниях. [52]
Следует иметь в виду, что данные о константах скорости различных реакций не всегда относятся к одинаковым условиям в отношении температуры, рН и ионной силы. Поэтому следует тщательно рассматривать все экспериментальные условия по оригинальным публикациям, в которых эти константы были получены. Однако изменения скорости, определяемые условиями эксперимента, по всей вероятности, не существенны по сравнению с изменениями, индуцированными белком, что позволяет в дальнейшем обсуждении пренебрегать влиянием условий опытов. В ряде случаев мы будем сравнивать активность различных комплексов и белков с активностью железодейтеропорфирина. Поскольку замена железопро-топорфирина в цитохром с-пероксидазе на железодейтеропорфирин дает искусственный фермент с активностью, составляющей 97 % активности нативного белка ( разд. [53]
Доти и Эдсалл [ 154а ] отмечают, что исследование вязкости приводит к выводу, согласно которому альбумин - S-Hg-S - альбумин является более асимметричным, чем альбумин - SH, однако молекула первого из этих соединений короче, чем две молекулы альбумина - SH, соединенные друг с другом концами. Это позволяет предположить, что в данном случае две молекулы альбумина в значительной степени перекрывают друг друга. Исследование дезаминированного яичного альбумина является примером того, как измерение асимметрии помогает сделать выбор между натив-ным и денатурированным производными белка. Отношение коэффициентов трения ( рассчитанное по диффузионным и седимента-ционным константам), так же как и относительная вязкость растворимой частично дезаминированной фракции В, согласуется в пределах ошибок опыта с соответствующими значениями для исходного нативного белка. [54]
Панкреатическая рибонуклеаза гидролизует рибонуклео-тидные связи, в которых пиримидиновый нуклеозид этерифицирован по З - положению сахара. Этот фермент содержит 124 остатка аминокислот и четыре дисульфидные связи. Последовательность частично была определена на окисленной рибонуклеазе, которая при энзиматическом расщеплении дает 24 пептида. Их размеры позволяют непосредственно определить последовательность химическими и ферментативными методами. Наконец, ферментативный гидролиз нативного белка, разделение содержащих цистин пептидов, окисление их до цистеиновых пептидов и аминокислотный анализ последних позволили выяснить, каким образом восемь по-луииетшювых остатков ( связаны друг с другом ( рис. 27, стр. [55]
Страницы: 1 2 3 4