Активный белок
Cтраница 3
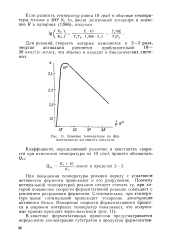 |
Влияние температуры на ферментативную активность каталазы. [31] |
При повышении температуры реакции наряду с усилением активности фермента происходит и его разрушение. Поэтому оптимальной температурой реакции следует считать ту, при которой повышение скорости ферментативной реакции совпадает с усилением разрушения ферментов. Следовательно, при - температуре выше оптимальной происходит ускорение денатурации активного белка. [32]
Поскольку общее содержание привязанного аффинанта одинаково в обоих колонках, во второй должен находиться иммуноглобулин, неспособный эффективно связывать антиген. При большом числе привязанных аминогрупп, очевидно, происходит нарушение нативной третичной структуры. Даже при низких рН могут быть получены сорбенты, содержащие достаточно много активного белка, присоединенного к сефарозе, если увеличить количество бромциана при активации носителя и количество белка при его привязке. [33]
До настоящего времени в белкоаой химии сохранился термин неупорядоченная структура или неупорядоченный ( статистический) клубок. Так называют любые пространственные формы полипептидной цепи, которые не охватываются каноническими конформациями. Такого рода рассмотрение постепенно утрачивает свое значение, ибо неупорядоченная структура, если она входит в состав биологически активного белка, должна описываться в точных терминах ( углы Ч У У. [34]
Эукариотические гены одних видов были также клонированы и экспрессировались в клетках других видов. Например, ген, кодирующий tx - цепь гемоглобина кролика, был введен в растущие в культуре мышиные клетки и экспрессировался в них. Внедрение чужеродного гена в эукариотические клетки не всегда, однако, сопровождается его транскрипцией и трансляцией с образованием активного белка. Регуляция экспрессии генов у эука-риот пока еще мало изучена ( разд. [35]
При изучении механизма восстановления нитратов в растениях прежде всего возникает вопрос о том, восстанавливается ли азотная кислота нитратов в свободном или в связанном состоянии. С первого взгляда кажется невозможным, чтобы слабой кислотности растительного сока было достаточно для вытеснения азотной кислоты из нитратов. Исходя из этого соображения, Лев и выдвинул гипотезу об обмене атомов между нитратами и восстановителями под каталитическим действием активного белка. Однако существует ряд фактов, доказывающих, что невозможность тут скорее кажущаяся, чем действительная. Во-первых, нитраты находятся в клеточном соке в виде чрезвычайно разбавленных растворов, что, как известно, способствует диссоциации солей. Во-вторых, вследствие окислительных процессов, протекающих в клетках ( дыхание), клеточный сок содержит большие количества углекислоты, которая может, согласно закону действующих масс, вытеснить некоторое количество азотной кислоты из нитратов. Наконец, в-третьих, раствор азотнокислого калия, подвергнутый действию солнечных лучей, разлагается, как показал ЛоранБ, с выделением кислорода и образованием азотистокислого калия. [36]
Их получают из сыворотки крови животных, у которых выработан иммунитет к данному заболеванию. В крови таких животных имеются, как уже сказано, белки - антитоксины ( антитела), нейтрализующие действие болезнетворных микробов. Чтобы получить и использовать антитоксины, у животных берут кровь, отделяя затем из нее сыворотку, которая, однако, содержит много балластных протеинов, понижающих концентрацию активного белка ( антитоксина) и загрязняющих его. Вследствие этого при введении в организм человека она может вызвать тяжелую сывороточную болезнь. Во избежание этого сыворотку очищают от примесей. Для этой цели применяют протеолитичес-кий фермент. Особенно эффективным оказался пепсин, который в определенных условиях расщепляет балластные белки сыворотки, почти не затрагивая содержащегося в ней активного начала. [37]
Действуя одновременно и альдегидной и амидной группой, он должен обладать во много раз большей способностьк реагировать и конденсироваться, чем синильная кислота. Лев не вовлек это давно уже известное соединение в круг свои ] соображений. Вместо того чтобы выводить свой активный белок из аспа рагинового альдегида, привлекая реакции, противоречащие установлен ным химическим фактам, он мог бы использовать для своего синтеза форм амид, прибавляя к нему необходимое число атомов углерода и водорода Наши знания от этого, конечно, не продвинулись бы, но его гипотез выиграла бы в правдоподобности. [38]
Для того чтобы активный белок обладал восстановительной способностью, он должен иметь альдегидные свойства. С другой стороны, для того чтобы он мог выделять энергию в результате интрамолекулярного перемещения атомов, нужно, чтобы в присутствии альдегидных групп активного белка находились другие группы, с которыми они могли бы реагировать внутри молекулы. Как известно, альдегиды чрезвычайно легко соединяются с амидами. Так как амидная природа белка не вызывает никаких сомнений, то Леп считает, что активный белок содержит в несвязанном виде многочисленные альдегидные и амидные радикалы и поэтому имеет большой запас энергии. Как только оба типа радикалов соединяются, активный белок теряет свойства альдегида и становится пассивным, выделяя энергию. Эта энергия играет, как мы скоро увидим, существенную роль в восстановлении нитратов. [39]
За некоторыми исключениями, антибиотики из спорообразующих бактерий представляют собой вещества белковой природы - полииеп-тиды. Они состоят из различных аминокислот, причем наиболее характерным является то, что в состав полипептидных антибиотиков входят неестественные аминокислоты с правой оптической конфигурацией. Некоторые антибиотики полипептидной природы имеют сравнительно более простой состав и несложную формулу, представляя весьма удобную модель для изучения строения белка. С другой стороны, полипептидные антибиотики привлекают большой интерес биохимиков, так как эти вещества могут быть использованы при изучении одной из центральных проблем современной биологии - выяснении причин, обусловливающих специфичность биологически активного белка. [40]
Для того чтобы активный белок обладал восстановительной способностью, он должен иметь альдегидные свойства. С другой стороны, для того чтобы он мог выделять энергию в результате интрамолекулярного перемещения атомов, нужно, чтобы в присутствии альдегидных групп активного белка находились другие группы, с которыми они могли бы реагировать внутри молекулы. Как известно, альдегиды чрезвычайно легко соединяются с амидами. Так как амидная природа белка не вызывает никаких сомнений, то Леп считает, что активный белок содержит в несвязанном виде многочисленные альдегидные и амидные радикалы и поэтому имеет большой запас энергии. Как только оба типа радикалов соединяются, активный белок теряет свойства альдегида и становится пассивным, выделяя энергию. Эта энергия играет, как мы скоро увидим, существенную роль в восстановлении нитратов. [41]
Функционально активная генетическая единица в данном случае состоит из двух сегментов, или цистронов - А и В - которые располагаются рядом на генетической карте. Каждый цистрон в отдельности контролирует синтез специфической молекулы, которая, однако, сама по себе неактивна даже будучи абсолютно неповрежденной. Продукты цистронов А к В должны объединиться для того, чтобы возникла активная структура. Мутации в каком-либо из двух цистронов приводят к синтезу дефектной молекулы, не способной к образованию активного продукта при взаимодействии с нормальным продуктом второго цистрона. Естественно предположить, что генетическая единица функции - ген или цистрон - кодирует субъединицу белка - индивидуальную полипептидную цепь. Допустим, что функционально активный белок состоит из п полипептидных цепей ( субъединиц), связанных друг с другом ковалентными или другими связями. Для кодирования такого белка необходимо п цистронов. Поэтому мы и предполагаем существование двух полипептидных цепей, соответствующих двум цистронам области rll. Если активный белок состоит из одной полипептидной цепи, то ген, кодирующий этот белок, эквивалентен цистрону. Если даже мутация А - - а или В - Ъ приводит к полному отсутствию соответствующего полипептида или к образованию совершенно искаженного полипептида, несомненно, что до тех пор, пока в клетке имеются нормальные аллели, детерминирующие полипептидные субъединицы А и В, внутриклеточный фонд будет содержать некоторое количество этих субъедивиц. [42]
Функционально активная генетическая единица в данном случае состоит из двух сегментов, или цистронов - А и В - которые располагаются рядом на генетической карте. Каждый цистрон в отдельности контролирует синтез специфической молекулы, которая, однако, сама по себе неактивна даже будучи абсолютно неповрежденной. Продукты цистронов А к В должны объединиться для того, чтобы возникла активная структура. Мутации в каком-либо из двух цистронов приводят к синтезу дефектной молекулы, не способной к образованию активного продукта при взаимодействии с нормальным продуктом второго цистрона. Естественно предположить, что генетическая единица функции - ген или цистрон - кодирует субъединицу белка - индивидуальную полипептидную цепь. Допустим, что функционально активный белок состоит из п полипептидных цепей ( субъединиц), связанных друг с другом ковалентными или другими связями. Для кодирования такого белка необходимо п цистронов. Поэтому мы и предполагаем существование двух полипептидных цепей, соответствующих двум цистронам области rll. Если активный белок состоит из одной полипептидной цепи, то ген, кодирующий этот белок, эквивалентен цистрону. Если даже мутация А - - а или В - Ъ приводит к полному отсутствию соответствующего полипептида или к образованию совершенно искаженного полипептида, несомненно, что до тех пор, пока в клетке имеются нормальные аллели, детерминирующие полипептидные субъединицы А и В, внутриклеточный фонд будет содержать некоторое количество этих субъедивиц. [43]
Страницы: 1 2 3