Ферментный белок
Cтраница 3
Возникает еще один вопрос: каким образом содержащаяся в генах информация определяет специфическую активность и другие свойства ферментов и как она преобразуется в аминокислотную последовательность ферментного белка. ДНК, будучи носителем наследственной информации, тем не менее сама не служит матрицей для синтеза полипептидов. Биосинтез белков происходит на рибосомах, которые непосредственно с ДНК не соприкасаются. ДНК, причем механизм этого процесса сходен с механизмом репликации ДНК. Образование мРНК начинается на 5 - ОН-конце, и по последовательности оснований ее цепь комплементарна цепи ДНК. Таким образом, при синтезе мРНК просто копируется нуклеотидная последовательность ДНК. [31]
Действие всех ферментов в сильной степени зависит от рН среды, даже при тех рН, когда и речи быть не может об инактивации ( денатурации) ферментного белка из-за щелочной или кислой реакции. Тот оптимум, который наблюдается при графическом изображении его действия в зависимости от рН, является истинным, в отличие от температурного, который легко можно сместить. [32]
Существуют различные пути исследования активных центров: изучение электрохимических свойств групп, связывающих субстрат, инактивация фермента разнообразными специфическими ингибиторами, исследование активности фрагментов ( осколков) ферментного белка, образующихся при его расщеплении протеи-назами и, наконец, изучение моделей ферментов. [33]
Активная группа может быть прочно связана с белком и не терять связи с ним в процессе катализа, но может удерживаться и очень слабо и в ходе метаболических реакций переходить с одного ферментного белка на другой. В этом случае активную группу часто называют коферментом. Ко-фермент, субстрат и белок объединяются в общий комплекс в момент реакции. Мы встречаемся здесь с весьма своеобразным явлением, резко отличающимся от тех, к которым мы привыкли при изучении обычных каталитических реакций в неживой природе. Динамические свойства ферментов определяются динамикой образования и распада белковых структур высших порядков и самого белка. Если же активная группа фермента имеет небелковую природу, то, вообще говоря, скорость обмена белковой и небелковой частей могут и не совпадать. Активные группы некоторых ферментов представляют собой витамины; запас витаминов в организме нуждается в постоянном пополнении, так как высшие организмы не способны сами синтезировать их. Это тот крайний случай, когда скорость образования активной группы сама по себе равна нулю и практически зависит от темпа введения витаминов с пищей. [34]
В другом случае ( на схеме - путь Б) из рефрижератора ( позиция 9) раствор фермента пропускают через мембранный фильтр, добавляют к нему электролит, например, натрия сульфат, для высаливания ферментного белка, пропускают через фильтро-пресс. Фермент собирают и смешивают с встречным потоком раствора концентрата того же фермента ( путь А) с последующим высушиванием в вакуум-распылительной сушилке. Сухой экстракт собирают в накопителе, стандартизуют по активности и подают на расфасовку и упаковку. [35]
Пиридиновый и пуриновый циклы пространственно сближены и, по-видимому, находятся на близких к параллельным плоскостях, что облегчает взаимодействие между атомами азота аминогруппы и других гетероциклов, возможно, за счет водородных связей, с активными центрами ферментного белка. О возможности внутримолекулярного взаимодействия пиридиновой и адениновой части в молекуле НАД получены некоторые данные электронных спектров [254], ПМР-спектров [255] и спектров флуоресценции [256], из которых следует, что НАД в водном растворе находится в свернутой конформации. [36]
 |
Схема структуры биологической мембраны ( по Фоксу, 1972. [37] |
Как уже говорилось, ненасыщенные жирные кислоты, возможно, служат более мощными активаторами белковой части липопротеидных ферментов, и поэтому уменьшение степени насыщенности липидов при низких температурах могло бы приводить к компенсаторному изменению активности фермента без какого-либо увеличения концентрации ферментного белка. [38]
Однако выбор субстратов, которые преобразуют коферменты, от них, по-видимому, не зависит. Следовательно, именно ферментный белок обладает специфичностью в отношении субстрата. [39]
Ферменты входят в состав клеток растений, животных и микроорганизмов в виде сложных, многокомпонентных соединений. Для получения ферментного препарата необходимо извлечь ферментный белок из клеток сырьевого источника и провести соответствующую очистку для удаления сопутствующих балластных веществ, отрицательно влияющих на активность и выход целевого продукта. [40]
Раньше считалось, что денатурация является полностью процессом необратимым. Павлов впервые показал, что денатурация ферментного белка - пепсина - щелочью в определенных условиях имеет обратимый характер. В настоящее время установлено, что представление о необратимости денатурации белковых веществ является неточным. Дена-турационные изменения на первых этапах могут иметь обратимый характер. Однако обычно вслед за обратимой фазой процесса наступают более глубокие изменения, связанные с взаимодействием денатурированных частиц друг с другом, имеющие необратимый характер. [41]
Кристаллизация описанным способом проста. Также легко проходит и многократная перекристаллизация ферментного белка, однако дальнейшей очистки его при этом не происходит. Форма кристаллов отличается от полученных японскими авторами и представлена на рис. 33 Протеаза Str. [42]
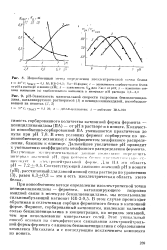 |
Ионообменный метод определения изоэлсктрнческой точки белка. [43] |
При ионообменном методе определения изоэлектрической точки пенициллинамидазы - фермента, катализирующего гидролиз амидной связи в молекуле бензилпенициллина, мы использовали сильнонабухающий катионит КБ-2-05. В этом случае происходит обратимая и селективная сорбция ферментного белка в катионной форме. [44]
Экстракт, полученный в результате избирательной экстракции наряду с ферментами содержит балластные белки, липиды, пигменты, неорганические ионы, полисахариды, а также другие вещества неферментной природы. Удаление балластных компонентов и достижение высокой степени чистоты ферментного белка требует сочетания различных методов препаративного выделения. На первой стадии очистки экстракта может быть использована кислотная денатурация, позволяющая за счет смещения величины рН среды перевести в нерастворимое состояние балластные белки. Иногда, с осторожностью, проводят их Уемпературную денатурацию путем кратковременного прогрева экстракта при температурах, не вызывающих денатурацию выделяемого фермента. Указанные методы могут сочетаться. Применяют также осаждение неактивных примесей солями тяжелых металлов. [45]
Страницы: 1 2 3 4