Бензилгалогенид
Cтраница 1
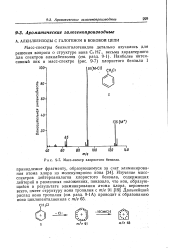 |
Масс-спектр хлористого бензила. [1] |
Масс-спектры бензилгалогенидов детально изучались для решения вопроса о структуре иона С. Hf, весьма характерного для спектров алкилбензолов ( см. разд. [2]
Реакции бензилгалогенидов всегда протекают без перегруппировок ( замещающая группа присоединяется только к тому углеродному атому, с которым раньше была связана уходящая группа), так как в результате присоединения к бензольному кольцу образовался бы продукт реакции без резонансной стабилизации бензольного кольца. [3]
Пик молекулярного иона бензилгалогенидов обычно определяется без труда. Образование бензильного ( или тропилиевого) иона при отрыве галогена ( разд. VII, правило 8) преобладает даже над разрывом р-связи алкильного заместителя. Замещенный фенильный ион ( разрыв а-связи) дает характерный пик в случае, если цикл является полизамещенным. [4]
Полибензилы получают поликонденсацией бензилгалогенидов или л-ксилилендигалогенидов, либо простых диэфиров л-ксилилен-гликоля с ароматическими углеводородами по Фриделю - Крафтсу. [5]
В эфирном растворе взаимодействие бензилгалогенидов также происходит как типичная реакция в пограничной области. [6]
При а-отщеплении галогеноводорода от бензилгалогенидов или от дифенилгалогенметанов с помощью металлоорганических соединений образуются промежуточные частицы, которые могут реагировать дальше с избытком основания. [7]
В случае алифатических первичных алкилгалогенидов и бензилгалогенидов реакция с цианидами щелочных металлов даже в протонных растворителях ( спиртах, водно-спиртовых смесях) протекает главным образом с образованием нитрилов и нежелательное образование изонитрилов, которые могут быть легко обнаружены по чрезвычайно неприятному запаху, протекает лишь в очень небольшой степени. В случае замещенных бензилгалогенидов ( например, при наличии / - и - НИ-заме-стителей типа алкил - и алкоксигрупп; см. разд. Таким образом затрудняется также возможный для этих реакционноспособных галоге-нидов сольволиз до бензиловых спиртов и простых бензиловых эфиров. [8]
Реакции SN2 с участием аллил - и бензилгалогенидов ускоряются вследствие стабилизации переходного состояния, достигаемой сопряжением тт-свя-зи ( или я-электронного облака бензольного кольца) ср-орбиталью, формирующейся на атоме углерода в переходном состоянии. Этот эффект сопряжения понижает энергию активации реакции 5д 2 и тем самым увеличивает ее скорость. [9]
Алкоксикарбонилирование арил -, винил - и бензилгалогенидов катализируется также и фосфиновыми комплексами Pd ( II) в присутствии третичного амина. [10]
Чрезвычайно реакционноспособны соединения типа аллил - и бензилгалогенидов. Действительно, аллилмагнийхлорид можно получить в открытом сосуде б ез специальных мер предохранения реакционной смеси от кислорода и влаги воздуха; однако такую методику нельзя рекомендовать. Основная трудность в данном случае состоит во взаимодействии реакционноспособ-ного аллилгалогенида и реактива Гриньяра. При больших концентрациях образуются с высокими выходами дибензил и диал-лил. Низкие концентрации и тщательное перемешивание способствует образованию реактива Гриньяра. [11]
Другие обменные реакции 2 4 6-триметил - бензилгалогенидов, например с алкиланилинами [154], цианид-ионом [155] и алкоксид-ионами [156], тоже, по-видимому, протекают нормально. [12]
Образование неустойчивых промежуточных соединений доказано на примере восстановления бензилгалогенидов. При препаративном электролизе бензилхлорида образуется толуол. При восстановлении его в нестрого контролируемых условиях в присутствии двуокиси углерода образовывалась фенилуксусная кислота, что указывает на участие в реакции бензил-карбаниона. Образование в этой реакции бутана и бутена в отношении 8: 1 указывает на то, что в ней участвует ион тетрабутиламмония из фонового электролита: в результате разряда ионов тетрабутиламмония образуются бутил-радикалы, которые отнимают водород от растворителя. [13]
На этом основании механизм нуклеофильного замещения аллилга-логенидов, бензилгалогенидов и галогеналканов отличается от механизма такого же замещения в ряду винилгалогенидов и галогенареиой. Галогеналкины, как правило, не вступают в реакцию нуклеофильного замещения. [14]
Таким образом, анализ реакционной способности алкилга-логенидов и бензилгалогенидов приводит к выводу, что при изменении структуры субстрата, природы нуклеофила и уходящей группы ( см. 9.4.3) происходит постепенное изменение механизма от SN1 к 5 1-типу. Тесное переходное состояние SN2 - типа, характерное для реакций первичных алкильных соединений с сильным нуклеофилом, при введении заместителей, стабилизирующих карбокатион, или при уменьшении силы нуклеофила переходит в более рыхлое, в котором связь нуклеофила с атомом углерода слабая, а связь атома углерода с уходящей группой достаточно сильно растянута. [15]
Страницы: 1 2 3 4