Нитрогруппа
Cтраница 1
Нитрогруппы ( перешедшие из азотной кислоты) послужили внутренним источником кислорода, и при нагревании целлюлоза сразу же полностью окислилась. [1]
Нитрогруппы увеличивают также подвижность атомов водорода, находящихся по отношению к ним в о - или р-положении. Аналогичное явление наблюдается при взаимодействии т-динитро-соединений с цианистым калием. При нагревании спиртового раствора m - дииитробензола с цианистым калием прежде всего образуется 2 6-динитробензонитрил, который при дальнейшем действии цианистого калия превращается в 2-нитро-б - метокси-бензонитрил. Динитрохлорбензол в этих условиях превращается последовательно в 2 4-динитро - 3 - Цианхлорбензол и затем в 2-нитро - 3-циан - 4-метоксихлорбензол. [2]
Нитрогруппа может заместить в алкане каждую алкильную группу. При расщеплении высокомолекулярных мононитроалкатюв низкомолекулярные нитропарафины не образуются. Так, при нитровании изопентана ( 2-метилбутан) путем замещения алкильной группы нитрогруппой образуются следующие низкомолекулярные нитропарафины: 2-нитропропан, 2-нитробутан, нитроэтан и нитрометан. Вследствие замещения различных атомов водорода в молекуле изопентана образуются 1-нитро - 2-метилбутан, 2-нитро - 2-метилбутан, 2-нитро - З - ме-тилбутан и 1-нитро - З - метилбутан. [3]
Нитрогруппа в 2-нитробензофуране активирует атом галогена, находящийся в соседнем положении 3, как это показано ниже ( стр. [4]
Нитрогруппы, например, восстанавливаются до аминогрупп при. [5]
Нитрогруппы ведут себя нормально и восстанавливаются при действии хлористого олова до аминогрупп. Монокалиевая соль 3 6-динитро - 2 7-диокси-флуорана восстанавливается редуцирующими сахарами с образованием 2 7-ди-оксиродамина. [6]
Нитрогруппа, вступая в положение 7, вызывает перемещение N-оксидиой группы на противоположную сторону фуроксанового кольца, ср. [7]
Нитрогруппа в З - метил-4 - ннтрофуроксане по своим геометрическим параметрам практически не отличается от нитрогрупп в ароматических иитросоединениях. Длина связей NO [ 1 215 ( 6) и 1 223 ( 5) А ] близка к средней статистической, установленной на большем числе примеров; длина этой связи у различных С-нитросоединеинй весьма постоянна и колеблется лишь в узком интервале - 1 22 0 01 А. [8]
Нитрогруппа в З - метил-4 - нитрофуроксане повернута вокруг связи CN на 16 7 по отношению к плоскости фуроксанового кольца. [9]
Нитрогруппа не участвует в отщеплении хлорид-аниона. [10]
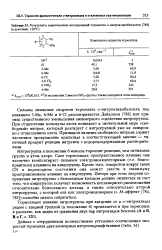 |
Результаты кинетических исследований термолиза о-нитроазидобензолов ( в декалине, 120 С. [11] |
Нитрогруппа в положении 6 меньше тормозит реакцию, чем метильная группа и атом хлора. Свое тормозящее пространственное влияние она частично компенсирует сильным электроноакцепторным ( т.е. благоприятным) влиянием на азидогруппу. Кроме того, поворотом вокруг связи CN в переходном состоянии она может свести к минимуму пространственное влияние на азидогруппу. Потеря при этом энергии сопряжения нитрогруппы с бензольным кольцом должна окупиться за счет того, что азидогруппа получает возможность копланарного расположения относительно бензольного кольца, а также относительно второй нитрогруппы, с которой она как электронодопорная ( М - эффект [784, 785]) способна сильно сопрягаться. [12]
Нитрогруппа является сильным заместителем второго рода. Ее ориентирующее действие выражено значительно сильнее, чем действие сульфогруппы, что объясняется большим эффектом сопряжения. Мононитросоединения нитруются до динитросоединений в значительно более жестких условиях, чем исходные углеводороды - до мононитросоединений. Благодаря этому мононитропродукты получаются практически без примеси полинитросоединений. [13]
Нитрогруппа в а-положении тоже может быть замещена, например, на фенил аминогруппу. [14]
Нитрогруппа отщепляется удобнее всего гидрированием в присутствии палладия или никеля Ренея или же в случае серусодержащих остатков аминокислот гидрированием с палладиевым катализатором при добавке эфира-та трифторида бора, хотя этот метод деблокирования не свободен от побочных реакций. [15]
Страницы: 1 2 3 4