Бензпинакон
Cтраница 2
Очень плохо растворимые спирты высокой молекулярной массы, такие, как гексадеканол-1, трифенилкарбинол или бензпинакон, не реагируют с цериевым реактивом и не дают красного окрашивания даже в диоксановом растворе. [16]
Было замечено 253а, что при гидролизе реакционных продуктов, состоящих из бензофенона, арилгалогенида и Mg, кетон восстанавливается в бензпинакон. Как показали дальнейшие исследования, восстановительной способностью обладает не реактив Гриньяра, а бинарная система Mg - j - MgJ2, причем последнее соединение образуется при прибавлении иода, который вводится для активации Mg. Для восстановления необходимо присутствие обоих веществ. Предполагается, что в результате реакции между Mg и MgJ2 образуется активный MgJ, который присоединяется к молекуле кетона, и тем самым углеродный атом карбонильной группы на некоторое время становится трехвалентным. [17]
Бензофенон имеет недостаточно высоко расположенный триплет-ный уровень, чтобы передавать энергию циклопентену, поэтому он не сенсибилизирует реакцию, а превращается при облучении в цикло-пептене в бензпинакон. Бензол ( ЕТ - 85 ккал / моль), по-видимому, должен сенсибилизировать эту реакцию, хотя эффективность его как сенсибилизатора может быть низкой. Однако инертность бензола в фотохимических реакциях дает большие преимущества, так как позволяет избежать вторичных реакций сенсибилизатора с олефином. Вследствие аномально большого синглет-триплет-ного расщепления в простых этиленах ( около 100 ккал / моль) триплет-ноз состояние бензола лежит на несколько килокалорий на 1 моль выше триплетного состояния циклопентена, в то время как синглет-ное состояние почти на 40 ккал / моль ниже синглетного состояния циклопентена. [18]
Выделившийся бензпинакон промывают разбавленной уксусной кислотой и пере-кристаллизовывают из кипящей ледяной уксусной кислоты. Бензпинакон плавится с разложением при 185 - 186 и распадается при этом на бензофенон и бензгидрол. [19]
Выпавпше после охлаждения кристаллы отфильтровывают, фильтрат еще раз кипятят с цинком и обрабатывают, как указано выше. Выделенный бензпинакон промывают разбавленной уксусной кислотой и первкристадлизовыванхг из кипящей ледяной уксусной кислоты. [20]
Ароматические кетоны восстанавливаются в пинаконы и электролитическим путем. Бензофенон восстанавливается в бензпинакон в эастворе из смеси H. [21]
Помещают 1 г бензофенона, 150 мл уксусной кислоты, 25 мл воды и 5 г цинковой пыли в круглодонную колбу емкостью 250 мл, присоединяют ее к обратному холодильнику ( прибор 2 в приложении 1) и кипятят смесь 2 час. Из реакционной смеси после охлаждения выпадает бензпинакон. Его отфильтровывают с отсасыванием и перекристаллизовывают из ледяной уксусной кислоты. [22]
При изучении перегруппировки тетра ( п-хлорфенил) - этиленгликоля и отвечающей ему окиси выяснилось что процесс течет мономолекулярно и скорости превращения гликол: и окиси примерно одинаковы. Оказалось, что вна чале расход бензпинакона превышает количество образующегос: бензпинаколина, а под конец реакции-наоборот. [23]
Добавляется для того, чтобы подавить разложение бензпинакона на бензофенон н бенз-гидрол. [24]
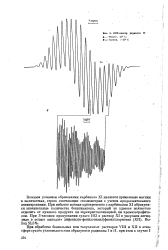 |
ЭПР-спектр радикала II. [25] |
Важным условием образования карбинола XI является применение магния э количествах, строго отвечающих стехиометрии с учетом продолжительного активирования. При избытке магния одновременно с карбинолом XI образуются значительные количества бензпинакона, который не удается полностью отделить от нужного продукта ни перекристаллизацией, ни хроматографиче-ски. [26]
Известно, что чисто ароматические пинаконы также претерпе вают пинаколиновую перегруппировку; для объяснения ее на ос нове представлений о циклизации в начальной стадии процесс; пришлось предположить, что в этом случае образующееся промежу точное соединение содержит четырехчленный цикл. Для выяснени: правильности этого предположения Монтань провел исследовашк перегруппировки n - галогензамещенных бензпинаконов. [27]
При применении этилового спирта реакция протекает медленнее и получается желтый раствор; однако кристаллы бензпинакона получаются бесцветными. [28]
Смесь карбонильных соединений содержала бензальдегид, бензофенон, бензил, бензоин и дифенилацетофенон. Кроме того, был идентифицирован ряд других соединений - фенол, бифенил, большое количество бензпинакона и других продуктов восстановления, бенз-гидрол, трифенилвиниловый спирт, трифенилкарбинол и трифе-нилметан. Было отмечено также наличие описанного Хейном хроморганического осадка. [29]
Патернб и Чиффи нашли [1], что на солнечном свету бензофенон с дифенилметаном образуют силш-тетрафенил-этиловый спирт ( I); подобная же реакция происходит и между бензофеноном и п, n - дианизилметаном. В последнем процессе, помимо 1 1-дифенил - 2 2-ди-п - анизилэтанола, были получены также бензпинакон и тетра-л-анизилэтан. [30]
Страницы: 1 2 3