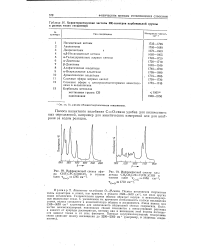
О-связи
Cтраница 2
Гибридные орбитали образуют о-связи С-С и С - Н, расположенные по прямой. [16]
 |
Молекула бензола. [17] |
Гибридные орбитали образуют о-связи С-С и С - Н, которые расположены в плоскости кольца под углом 120 друг к другу. [18]
 |
Электронная структура и гибридизация атомных орбиталей углерода в ацетилене. [19] |
Гибридные орбитали образуют о-связи С-С и С - Н, расположенные по прямой. [20]
Электрофильное замещение при о-связи в классической форме встречается при перегруппировках типа перемещений, вызванных электроноде-фицитными углеродсодержащими или неуглеродистыми активными частицами ( разд. В этих перегруппировках мигрирующий атом углерода сохраняет свою конфигурацию. [21]
Свободное вращение происходит вокруг о-связи, обладающей цилиндрической симметрией относительно осп связи, но л-связь не обладает цилиндрической симметрией относительно оси связи, и поэтому в этом случае существует барьер для вращения, объясняющий затрудненное вращение вокруг двойной связи С С. [22]
Атом азота образует две о-связи с атомами Y и Z. На р-орбите азота, перекрывающейся с р-орбитой атома Z, находится один электрон. На п-ор-бите, расположенной под углом 120 к связям N-Y и N-Z, находятся два несвязывающих электрона. [24]
Термическая стойкость Si - О-связи очень высока. Поэтому полисилоксаны являются термически стойкими соединениями. [25]
Реакции внедрения карбенов в о-связи пока не нашли столь широкого применения в органическом синтезе, как реакции 1 1-циклоприсоединения к кратным связям. Тем не менее отдельные реакции внедрения заслуживают упоминания как препаративные. [26]
 |
Схема, показывающая образование химических связей в молекуле. [27] |
Связь в отличие от о-связи не обладает цилиндрической симметрией относительно оси, соединяющей центры атомов. [28]
Полоса валентного колебания С О-связи удобна для количественных определений, например для кинетических измерений или для контроля за ходом реакции. [30]
Страницы: 1 2 3 4 5