Берсона
Cтраница 2
Как отмечали в своем обзоре Берсон и Эсак, история применения компьютера в любой области отличается первоначальным сверхоптимизмом, обусловленным большими успехами применения компьютеров для решения простых модельных задач в своей области. Действительно, общее отношение к эффективности применения компьютера в разработке планов синтезов в настоящее время гораздо более сдержанное, чем это было 30 лет назад, сразу же после этапных публикаций группы Кори. Тем не менее сохраняется огромный потенциал применения мощностей современных компьютеров для решения синтетических задач. [16]
В 1958 г. появилась интересная работа Берсона и Гринбау - ма62, посвященная механизму асимметрического синтеза в ряду оптически активных дифеновых производных. Прежде всего эти авторы рассматривают вопрос о конфигурации исходных веществ ( фенилдигидротебаина и его аналогов), подходя к решению этого вопроса следующим путем. [17]
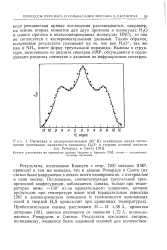 |
Расчетная и экспериментальная ( 90 К огибающая линии поглощения протонного магнитного резонанса Н3О в гидрате азотной кислоты ( по Ричардсу и Смиту. [18] |
Кривая рассчитана на основании данных Эндрью и Берсона [29]; точки - экспериментальные значения. [19]
Яснитский, К ром, Израилович, Берсон. [20]
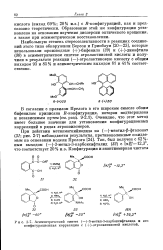 |
Асимметрический синтез ( - - 3-метил - 3-карбоксифталида и его конфигурационная корреляция с ( - атролактиновой кислотой. [21] |
Наибольшую степень стереоселективности в реакциях соединений этого типа обнаружили Берсон и Гринбаум [20-23], которые использовали производные () - бифенила ( 29) и () - динафтила ( 30) в асимметрическом синтезе атролактиновой кислоты и получили в результате реакции ( -) - атролактиновую кислоту с общим выходом 93 и 85 % и асимметрическим выходом 61 и 41 % соответственно. [22]
 |
Восстановление 4 - ( 4-бензоилфенил - 2-бутанона. [23] |
Независимость реакции Дильса - Альдера от окружающей среды ( см. работу Берсона и Реманика [117]) означает, что хотя в реакции и образуется комплекс с переносом заряда, но донорно-ащепторное взаимодействие в переходном состоянии выражено слабо. [24]
В первом описанном примере использования изотопного разбавления для определения энантиомерной чистоты Берсон и Бен-Эфраим [ 9] установили состав оптически активной смеси энантиомеров эндо-норборнанкарбоновой кислоты ( 1) и затем рассчитали абсолютное вращение () - эндо-норборнанкарбоновой кислоты. [25]
В работе [243] найдено, что константа aN лучше всего коррелирует с такими параметрами, как г-фактор Косовера, константы Димрота - Рейхардта и Берсона, и может быть использована в качестве параметра, характеризующего полярность среды. [26]
Модификацией синтеза атролактиновой кислоты по Прелогу могло бы быть восстановление фенилглиоксиловых эфиров литий-алюминийгидридом, в результате чего мог бы образоваться оптически активный р-фенилэтиловый спирт. Однако Берсон и др. [410] показали, что эта методика неприменима, так как образующийся гликоль имеет конфигурацию, обратную конфигурации атролактиновой кислоты. Это объясняется тем, что восстановление сложно-эфирной карбонильной группы протекает быстрее, чем восстановление а-карбонильной группы, в результате чего сложноэфирная связь рвется раньше, чем осуществляется полное восстановление. [27]
По мнению Берсона, такая селективность обусловлена близостью энергии переходного состояния для дезаминирования и энергетического барьера внутреннего вращения; благодаря этому конформационный состав основного состояния оказывает существенное влияние на то, какая именно группа мигрирует в процессе дез а минирования. [28]
Те, которые можно формально отнести к этой категории, например перегруппировка винилцикло-пропан - циклопентен, протекают с такой высокой энергией активации ( - 50 ккал / моль), что энергетическая поверхность для синхронной реакции не далеко отстоит от энергетической поверхности ступенчатого протекания процесса. Тем не менее Берсон и Нельсон [142] недавно сделали сенсационное наблюдение того, что ( 328) в результате синхронного разрешенного по симметрии супраповерхностно-го [ 1 31-смещения переходит в ( 329) при 307 с инверсией при мигрирующем центре, обозначенном звездочкой. [29]
В первом случае из оптически активного продукта был получен правовращающий ацетат ( 79), во втором - тот же ацетат ( 79), но левовра-щающий. Эти данные, по оценке Берсона, свидетельствуют о том, что скорость э / сзо-вицинального сдвига водорода по меньшей мере в 100 раз превышает таковую для эндо-вицинальнаго сдвига. [30]
Страницы: 1 2 3