Обмен - молекула
Cтраница 2
Дополнительное повышение чувствительности при наличии контактного вклада в релаксацию можно получить за счет повышения температуры, если контакт проявляется за счет обмена молекул из объема раствора с молекулами первой координационной сферы. [16]
Хотя в большинстве случаев можно было определить только нижний предел скоростей реакций, очевидно, что обмен молекул гликоля ненамного меньше скорости обмена молекул метанола. Это веское доказательство диссоциативного механизма, которому способствует растворитель, а не механизма SN1 для обменных процессов. Это означает, что в интермедиате / цикл будет многократно размыкаться и замыкаться, прежде чем произойдет отрыв второй связи и осуществится обмен. [17]
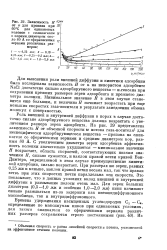 |
Зависимость Н нмм от w для пропана при 20 60 С для одинаковых колонок с силикагелем. б с порами диаметром около 80 А со сферическими зернами различных размеров. [18] |
Минимальное значение Н в этом случае становится еще большим, и величина Н начинает возрастать при еще меньших скоростях газа-носителя в результате замедления обмена молекул с поверхностью. [19]
 |
Положение молекул Н2О относительно ориентационных дефектов.| Возможный механизм переноса / - дефекта при переносе соответствующего D-дефекта из положения Ог-Ов в положение Oi-Оз. [20] |
Перенос DI - и 1 / - дефектов сопровождается перемещением D - и L-дефектов, которые приводят к диэлектрической релаксации; это сопровождается обменом молекул, расположенных в решетке и в полостях. [21]
Поскольку HFe ( CO) s и НМп ( СО) 5 имеют изоэлектронное строение ( а также, вероятно, и изоструктурное), интересно отметить, что скорость обмена молекул СО в НМп ( СО) 5 намного ниже скорости обмена карбонила в катионном комплексе. [22]
В данном разделе рассмотрено влияние некоторых анионов ( S203 -, P2O7 -, С2О4 - -, лактат-ионов), входящих во внутреннюю сферу комплексов ионов меди ( II), на скорости обмена молекул этилендиамина и моноэтаноламина. Во всех изученных нами смешанных комплексах ионов меди ( II) с аминами измеряемый на опыте коэффициент спин-спиновой релаксационной эффективности контролируется скоростью химического обмена молекул аминов внутренней сферы комплекса с аминами в массе раствора. [23]
Расположение и ориентация молекул солюбилизованных веществ весьма важны для понимания природы солюбилизации и физического и химического поведения молекул солюбялизованных веществ. Хотя обычно скорости обмена молекул солюбилизованных веществ между мономер. Таким образом, в зависимости от молекулярной структуры солюбилизата и структуры мицелл следует предположить наличие перераспределения или быстрого взаимного обмена между состояниями с различной ориентацией и энергией. В некоторых случаях требуются определенные локализация и ориентация. Таким образом, можно ожидать различий в локализации чисто гидрофобных растворенных веществ, таких, как гептан, и дифипь - ных растворенных веществ ( полярно-неполярных), таких, как гепта-нол, на структурной основе. Для гептана наиболее вероятно концентрирование в ядре, а гептанол будет располагаться подобно молекулам ПАВ таким образом, что его полярная головка закрепляется на поверхности раздела. [24]
Отрываясь от поверхности, молекулы оставляют вакансии, которые на какое-то время не успевают заполниться и это приводит к понижению плотности в поверхностном слое. При этом с возрастанием взаимной растворимости компонентов фаз увеличиваются интенсивность обмена молекул, межмолекулярное расстояние и понижается поверхностное натяжение. Такие представления позволяют объяснить большую активность молекул в паре, чем в растворе, так как коэффициент молекулярной диффузии в газовой фазе на 4 - 5 порядков больше, чем в жидкой. [25]
При рассмотрении стабильности сольватов различают кинетическую и термодинамическую устойчивости. Кинетическая устойчивость образующихся сольватов, согласно Самойлову, определяется энергией активации процесса обмена молекул растворителя вблизи иона на молекулы растворителя в объеме. [26]
Прочность связи между ионами металлов и молекулами воды может изменяться в широких пределах. В то время как у ионов А13, Ga3, Со3 и Тп4 обмен молекул Н2ИО на молекулы Н218О осуществляется приблизительно за 3 мин, обмен у гидратированных ионов Сг3 имеет период полураспада, равный 40 час. Гидроксильные ионы координируются катионами металлов еще сильнее, чем нейтральные молекулы воды. [27]
Одним из выводов простой теории является то, что минимальная энтропия плавления равна R. Эта величина была названа коммунальной энтропией по Эйрингу, так как она связана с обменом молекул в жидкости между ячейками. [28]
Эти скорости зависят от целого ряда факторов, которые не известны или плохо поняты ( см. гл. Однако мы знаем, что в тех условиях, в которых обычно осуществляются хроматогра-фпческие разделения, кинетика обмена молекул анализируемых веществ между подвижной и неподвижной фазами является очень быстрой. Действительно, эффективность колонки связана с кинетикой обмена между фазами. Если бы кинетика была бесконечно быстрой, эффективность колонки была бы бесконечно высокой и две фазы находились бы постоянно в равновесии. Это предположение приводит к модели идеальной хроматографии. Эффективность реальных колонок является конечной величиной ( см. гл. Отклонение от равновесия в центре пика или зоны обычно очень незначительно. [29]
К первичному акту процесса относится прямая мономолекулярная диссоциация молекул UFe, поглотивших такое количества ИК квантов, при котором запас колебательной энергии молекулы превышает границу диссоциации. Сюда же следует отнести возможный бимолекулярный распад молекулы, набравшей необходимый запас колебательной энергии при W - колебательном обмене высоковозбужденных молекул. [30]
Страницы: 1 2 3