Протонный обмен
Cтраница 2
Аналогичная же реакция протонного обмена происходит и при диссоциации кислот ( см. стр. То, что в водных растворах, по-видимому, вокруг протона группируется не одна, а много молекул Н2О ( см. стр. [16]
Подробно изучена кинетика протонного обмена между группой SH тиофенола и группой ОН метанола при кислотном и щелочном катализе. Обмен в этой системе идет на несколько порядков медленнее и с более высокой энергией активации, чем в аналогичной системе с участием фенола, что объяснено слабостью водородных связей, образуемых серой. Обоснован тримолекулярный механизм реакции с участием комплексов, образованных водородными связями. [17]
Для изучения кинетики протонного обмена в водных растворах иона метиламмония был использован метод ПМР. В растворителях с высокой диэлектрической проницаемостью, например в воде и метаноле, ионы ВН вовлечены главным образом в процессы: 1) переноса протона с ВН на растворитель, 2) прямого переноса протона с ВН на молекулу В, 3) переноса протона с ВН на молекулу В через растворитель. [18]
 |
Константы диссоциации воды. [19] |
Аналогичная же реакция протонного обмена происходит и при диссоциации кислот ( см. стр. То, что в водных растворах, по-видимому, вокруг протона группируется не одна, а много молекул Н2О ( см. стр. [20]
Экспериментальные исследования процессов протонного обмена в газовой фазе весьма немногочисленны. Имеющиеся данные показывают, что для разных систем механизм реакции может значительно различаться, хотя зависимость скорости процесса от способности молекул образовывать водородную связь, по-видимому, одинакова. Во всех случаях в растворе, а для аминов, спиртов, галогенводородов и фосфинов [82] в газовой фазе процессы переноса протона являются бимолекулярными. Полученные результаты интерпретированы Денисовым и Тохадзе [35], которые постулировали двухстадийный механизм реакции: а) образование бимолекулярного водородно-связанного комплекса и б) перенос протона либо в этом комплексе, активированном третьей молекулой, либо в тримолекулярном циклическом комплексе. Хотя такой двухстадийный механизм должен осуществляться и в растворителе, он не влияет на кинетические характеристики вследствие почти непрерывного обмена энергией между комплексами и средой. [21]
Аналогично рассмотренному выше протекает протонный обмен в метильных заместителях изотиазола: метильные группы в положении 5 депротонируются быстрее, чем в положении 3, а в 4-ме-тильной группе обмен практически не происходит. [22]
При повышении рН раствора протонный обмен становится существенным и спектр сразу существенно изменяется. [23]
Насколько быстрым должен быть протонный обмен, чтобы он приводил к исчезновению тонкой структуры, обусловленной спин-спиновым взаимодействием. [24]
Проблема лимитирующей стадии процессов протонного обмена еще далека от полной ясности. Как видно из уравнений (2.15) и (2.16), скорость реакции может определяться временем, необходимым для образования или распада промежуточного комплекса, либо временем переноса протона в этом комплексе. Поэтому нетрудно представить себе, что для разных молекулярных систем при различных условиях могут реализовываться все случаи. Нам известна всего одна система, где распад промежуточного комплекса может быть лимитирующей стадией протонного обмена: это протонный обмен между димерами карбоновых кислот, образующими прочные восьмичленные циклы. При изучении протонного обмена для НСООН Денисов и Голубев [26] пришли к выводу, что скорость этого процесса лимитируется разрывом водородных связей. [25]
Использование нейтральных электронодонорных растворителей затрудняет протонный обмен и способствует спин-спиновому расщеплению гидроксильного и а-углеродного протонов. [26]
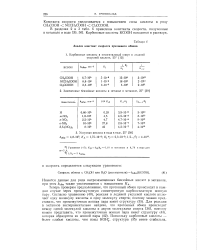 |
Анализ констант скорости протонного обмена. [27] |
Теперь проверим предположение, что протонный обмен происходит в каждом случае через промежуточную симметричную карбоксилатную ионную пару. [28]
Можно полагать, что скорость протонного обмена играет особенно значительную роль в растворах кислот и щелочей. Действительно, в работах Де Стефанф [67] и Вдовенко и др. [68] показано, что в растворах кислот Тг растет. Авторы связывают такие изменения с протонным обменом, с ходом диссоциации кислоты в воде и делают попытку рассчитать константу диссоциации. Полученная величина находится в разумном согласии с данными; Других методов. [29]
 |
Энтальпии образования водородно-связанных комплексов различных кислот с ( CD3 2 SO и кинетические характеристики переноса протона в комплексах, образуемых с ( СН3 СН2 3 N. [30] |
Страницы: 1 2 3 4