Медленный обмен
Cтраница 1
Медленный обмен tBT1 ( 2) B, тогда ( Т - ( 12) изм Рв 1 - Измеряемая величина времени релаксации определяется временем жизни ядра в первой координационной сфере. [1]
 |
Влияние обмена & T-1 2nSv ( 28. [2] |
Медленный обмен протоном между АН nBH ( TAv l) приводит к обменному уширению линий поглощения протонами в молекулах АН и ВН. [3]
Медленный обмен вызывает уширение спиновых мультиплетов, а при достаточно высоких скоростях обмена может произойти слияние мультиплета в одиночный сигнал. В случае быстрого обмена т значительно меньше величины обратной константы спин-спиновой связи и она в спектре не проявляется. Особенно наглядно это видно в случае обмена гидроксильных протонов спиртов. Примеси воды или кислот приводят к ускорению обмена протонов ОН-группы спиртов, ведущего к нарушению спин-спиновой связи между гидро-ксильным и другими протонами молекулы. [4]
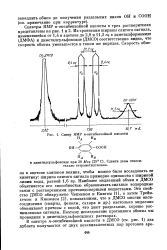 |
Спекр ЯМР га-оксибензойной кислоты. [5] |
Наиболее медленный обмен в ДМСО объясняется его способностью образовывать сильные водородные связи с растворенными протонодонорными веществами. Это свойство ДМСО обнаружено Чепменом и Кингом [1], а затем Трейн-хемом и Кнезелем [2], показавшими, что в ДМСО многие окси-соединения ( спирты, фенолы, сахара и др.) настолько медленно обменивают протоны с водой, что дают раздельные, хорошо расщепленные сигналы. [6]
Наблюдаемый медленный обмен в трианизилкарбшголе, некоторых третичных спиртах и в некоторых полпоксибензолах [15] имеет другой, еще недостаточно выясненный механизм. [7]
Для медленного обмена с кислотой протонов, находящихся в В-положении к группе ОН ( например, метальных протонов в 2-пропаноле), был найден еще один механизм. [8]
 |
Торможение оймена на амальгаме свинпа в 0 1 н. Pb4NO 2. [9] |
Для медленного обмена ( в комплексных растворах и при опытах с поверхностно-активными веществами) ролью диффузии безусловно можно было пренебречь. Этот вывод подтверждается рядом фактов: независимостью результатов, в довольно широких пределах, от скорости перемешивания, совпадением по порядку величины наших данных с данными Эршлера и Розенталь, полученных при помощи принципиально отличного метода: наконец, чрезвычайной чувствительностью тока обмена к введению комплексообразователей или поверхностно-активных еществ. В обоих этих случаях вязкость и коэффициенты диффузии ионов могли изменяться лишь незначительно. Следует заметить, что в большинстве наших опытов объемная концентрация обменивающегося металла в амальгаме была значительно ( на 1 - 2 порядка и более) выше, чем в растворе, вследствие чего основная часть градиента концентрации индикатора должна была во всяком случае падать на раствор. [10]
Для медленного обмена tAvo 1 и спектр состоит из двух отдельных пиков. [11]
Условия медленного обмена приводят к уширению обеих линий, а при ускорении обмена - к слиянию их в одну уширенную линию при выполнении условия. [12]
Условия медленного обмена приводят к уширению обеих линий, а при ускорении обмена - к слиянию их в одну уширенную линию при выполнении условия. [13]
Природа медленного обмена в гипофосфите при высокой температуре не ясна. Если обмен осуществляется через таутомерное превращение недиссоциированной кислоты, то принимая во внимание [ Н ] 10 - 7 в растворе соли, обмен в последней должен иметь при 25 С полупериод 108 мин, что исключает возможность его обнаружить. При 100 С обмен тогда имел бы скорость, отвечающую найденной нами при энергии активации, порядка 35 ккал / молъ. Этот механизм, однако, не объясняет сильного ускорения обмена щелочью, которое также противоречит и гидролитическому механизму. [14]
 |
Исчезновение расщепления при ускорении обмена. [15] |
Страницы: 1 2 3 4