Электронная оболочка
Cтраница 2
Электронная оболочка сурьмы может расшириться. [16]
 |
Модель по Стюарту - Бриглебу молекулы 2 6 2 6 -тетрахлордифенила. [17] |
Электронная оболочка многоэлектронного атома построена так, что всегда выполняется принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. [18]
 |
Три предельных случая электронного взаимодействия между посторонними молекулами и адсорбирующей поверхностью металла. [19] |
Электронная оболочка адсорбирующейся молекулы является полностью завершенной ( например, атомы редких газов); молекула не обладает сродством к электрону и ее поляризуемость мала. Поэтому она не приобретает и не отдает электронов. Однако в самой молекуле возможен небольшой сдвиг электронов по направлению к металлу, если сродство к электрону у поверхности металла велико. [20]
Электронные оболочки сближающихся молекул начинают взаимно отталкиваться еще до вступления молекул в контакт друг с другом. [21]
Электронная оболочка жестких кислот характеризуется высокой стабильностью относительно внешних электрических полей. Наиболее жесткой кислотой является протон, который из-за отсутствия электронной оболочки и чрезвычайно малого радиуса прочно связывается с активным центром молекулы основания. Недеформируемой электронной оболочкой обладают также катионы с электронной конфигурацией инертного газа, такие как Li, Ca2, A13, Ti4, в которых электрические и магнитные моменты всех электронов полностью скомпенсированы. Эти катионы образованы в основном элементами главных подгрупп периодической системы. Способность к присоединению оснований возрастает по мере увеличения ионного потенциала. [22]
 |
Формы атомных s - ( а и р-орбиталей ( б. [23] |
Электронная оболочка любого атома представляет собой сложную систему. Она делится на подоболочки с разной энергией ( энергетические уровни); уровни, в свою очередь, подразделяются на подуровни, а подуровни геометрически изображаются атомными орбиталями, которые могут различаться формой и размерами. [24]
Электронные оболочки валентно-несвязанных атомов взаимно отталкиваются. Силы дисперсионного притяжения между парой валентно-несвязанных атомов уравновешиваются отталкиванием электронных оболочек. Слейтер [48] описал отталкивание экспоненциальной функцией, которая была модифицирована Букингемом [49] и носит его имя. С учетом лондоновского члена для дисперсионных сил [45] это приводит к простому в вычислительном отношении потенциалу 6 - 12, пример которого приведен на рис. 3.1. Оба параметра, необходимых для определения этой функции, описаны в подписи к Рисунку. [25]
Электронные оболочки отрицательных ионов деформируются под действием сил положительных ионов, и тем сильнее, чем меньте радиус и чем больше заряд положительных ионов. Ионы с конфигурацией инертного газа проявляют меньшее деформирующее влияние, чем остальные ионы. Поэтому влияние деформации в общем случае становится особенно сильным в соединениях элементов побочных подгрупп. [26]
Электронные оболочки валентно-несвязанных атомов взаимно отталкиваются. Силы дисперсионного притяжения между парой валентно-несвязанных атомов уравновешиваются отталкиванием электронных оболочек. Слейтер [48] описал отталкивание экспоненциальной функцией, которая была модифицирована Букингемом [49] и носит его имя. С учетом лондоновского члена для дисперсионных сил [45] это приводит к простому в вычислительном отношении потенциалу 6 - 12, пример которого приведен на рис. 3.1. Оба параметра, необходимых для определения этой функции, описаны в подписи к Рисунку. [27]
Электронные оболочки отрицательных ионов деформируются под действием сил положительных ионов, и тем сильнее, чем меньше радиус и чем больше заряд положительных ионрв. Ионы с конфигурацией инертного газа проявляют меньшее деформирующее влияние, чем остальные ионы. Поэтому влияние деформации в общем случае становится особенно сильным в соединениях элементов побочных подгрупп. [28]
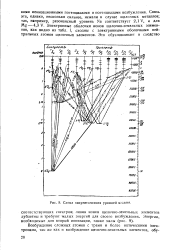 |
Схема энергетических уровней кадмия. [29] |
Электронные оболочки ионов щелочно-земельных элементов, как видно из табл. I, сходны с электронными оболочками нейтральных атомов щелочных элементов. [30]
Страницы: 1 2 3 4