Образование - малорастворимый осадок
Cтраница 3
Если содержание сульфатов в электролите меньше 0 01 %, применяют фототурбидиметрический метод, основанный на образовании малорастворимого осадка - BaSC4 ( см. стр. При анализе электролита определение проводят с помощью фотоколориметра типа ФЭК-56 так же, как в хлорате натрия. [31]
При взаимодействии двух электролитов, из которых один содержит, например, ион Ме2, а другой - ион S, образование малорастворимого осадка MeS происходит только в том случае и до тех пор, пока произведение концентраций ионов в растворе [ Ме2 ] [ S2 - ] будет превышать ПР этого соединения. Когда произведение концентраций ионов достигает значения ПРмгя, устанавливается равновесие между твердой фазой и ее насыщенным раствором и образование осадка практически прекращается. [32]
Если содержание сульфатов в электролите составляет менее 0 01 %, применяют не весовой метод, а нефелометрический, основанный на образовании малорастворимого осадка - BaSO4 ( см. стр. При анализе электролита определение проводят с помощью фотоколориметра. [33]
При взаимодействии двух электролитов, из которых один содержит, например, ион Me24, а другой - ион S2 -, образование малорастворимого осадка MeS происходит только в том случае и до тех пор, пока произведение концентраций ионов в растворе [ Ме2 ] [ S2 - ] будет превышать ПР этого соединения. Когда произведение концентраций ионов достигает значения ПРмез, устанавливается равновесие между твердой фазой и ее насыщенным раствором и образование осадка практически прекращается. [34]
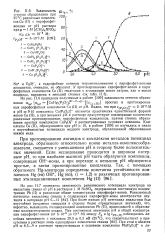 |
Зависимость степени образования при 25 С различных комплексов Си ( II с пирофосфат. [35] |
На рис. II.7 приведена зависимость равновесного потенциала электрода из амальгамы свинца от рН в растворах 1 М NaN03, содержавших постоянную концентрацию РЬ ( II) и различные общие концентрации пирофосфат-ионов. При более низких рН потенциал амальгамы был неустойчив ( медленно смещался в сторону более отрицательных значений), что, вероятно, вызывалось полимеризацией комплексов РЬ ( II), приводившей к образованию малорастворимого осадка. [36]
Поскольку реакции между ионами в растворе представляют собой пример химического равновесия, к ним приложим принцип смещения равновесий Ле Шателье. Удаление вещества может быть осуществлено следующим путем: 1) образованием малорастворимого осадка; 2) выделением газообразного продукта реакции; 3) образованием малодиссоциированного соединения; 4) образованием прочного комплекса. [37]
Поскольку реакции между ионами в растворе представляют собой пример химического равновесия, к ним приложим принцип смещения равновесий Ле Шателье. Удаление вещества может быть осуществлено следующим путем: 1) образованием малорастворимого осадка; 2) выделением газообразного продукта реакции; 3) образованием малодиссоциированного соединения; 4) образованием прочного комплекса. Примером реакции первого типа может служить взаимодействие КС1 с AgNO3 с образованием малорастворимого в воде осадка хлорида серебра. [38]
Поскольку реакции между ионами в растворе представляют собой пример химического равновесия, к ним приложим принцип смещения равновесий Ле Шателье. Удаление вещества может быть осуществлено следующим путем: 1) образованием малорастворимого осадка; 2) выделением газообразного продукта реакции; 3) образованием малодиссоциированного соединения; 4) образованием прочного комплекса. [39]
Поскольку реакции между ионами в растворе представляют собой пример химического равновесия, к ним применим принцип смещения равновесия Ле Шателье. В соответствии с этим принципом равновесие может сместиться, если какое-либо вещество будет удаляться из сферы реакции по мере ее протекания. Удаление вещества может быть осуществлено в трех случаях: 1) образование малорастворимого осадка; 2) выделение газообразного вещества; 3) образование малодиссоциированного соединения. [40]
Равновесное состояние пластовых вод, являющихся сложными системами, легко нарушается с изменением пластовых условий - снижении давления, температуры, при контакте с другими пластовыми или пресными водами. При дегазации пластовых вод может существенно измениться показатель рН, влияющий на растворимость солей. Например, при дегазации сероводородсодержащих вод рН среды увеличивается вследствие выделения сероводорода; выделение углекислого газа из пластовых вод, пересыщенных ионами кальция, приводит к образованию малорастворимого осадка карбоната кальция. Растворимость солей, в свою очередь, меняется с изменением температуры, поэтому при охлаждении призабойной зоны может начаться осадкообразование. [41]
Нептуний ( 1У) - пентафторид аммония - NH NpFs выделяется ь виде ярко-зеленого зернистого осадка при добавлении плавиковой кислоты к раствору Np ( IV) в присутствии ионов NHI. Если прибавлять HF к раствору Np ( V), содержащему ионы аммония и восстановитель, например SCh, то выпадает такой же двойной фторид. Очевидно, образование малорастворимого осадка способствует переходу нептуния в четырехвалентную форму. [42]
Страницы: 1 2 3