Образование - ионная пара
Cтраница 3
Необходимо было ввести дополнительные поправки на образование ионной пары при получении данных для концентрированных растворов нитр ата аммония. [31]
Это значение является константой равновесия для образования ионной пары во внутренней сфере из ионной пары, разделенной растворителем. [32]
Уравнение ( 3) описывает процесс образования ионной пары в соответствии с обсуждаемой выше схемой. [33]
Это также можно рассматривать как подтверждение образования близкой ионной пары в качестве промежуточной частицы, так как найдено, что даже очень большие концентрации HOTs [15] не ингибируют реакцию. Однако этому факту не следует предавать очень большого значения, так как HOTs чрезвычайно слабо ионизована в слабом диэлектрике - уксусной кислоте. [34]
Другой путь изменения - фактора при образовании ионной пары состоит в переносе спина на катион. Если катион характеризуется сильным спин-орбитальным взаимодействием, то при этом появится орбитальное движение. Однако это эффект второго порядка, поскольку спин на внешней s - орбитали не может давать вклада в сдвиг. Следует ожидать, что сдвиг - фактора обусловлен небольшой заселенностью внешней р ( а) - орбитали, взаимодействующей с р ( я) - орбиталью. Если такая возможность реализуется, то наблюдается отрицательный сдвиг g - фак-тора. [35]
В первом приближении зависимость константы равновесия К образования ионной пары можно представить, используя электростатическую модель, с помощью уравнения К А ( 1 / е) ( z z - / r2), где е - диэлектрическая проницаемость растворителя, z, z - - заряды принимающих участие в реакции ионов, г - расстояние между их центрами, А - коэффициент пропорциональности. Это уравнение убедительно показывает, что реакции ассоциации благоприятствует низкая диэлектрическая проницаемость растворителя, высокие заряды растворенных ионов и малые радиусы последних. [36]
Степень поляризации связи С - С1 и образования ионной пары в таких комплексах зависит от строения алкильной группы ( трет - втор - пере -), природы галогена ( F С1 Вг) и элек-трофильности апротонной кислоты. [37]
В системе a - MST - PMDA образование ионной пары из синглетного возбужденного состояния не наблюдается; обнаруживается лишь медленная ионная диссоциация, происходящая предположительно из триплетного состояния. Дезактивация синглетного возбужденного состояния, обусловленная безызлучатель-ными переходами в триплетное и основное состояния этой системы, может происходить гораздо быстрее, чем в комплексе с TCNB. Следовательно, ионная диссоциация из триплетного состояния играет важную роль и в этих системах, подобно тому, как это имеет место в системах хлорофиллхинон или Bph - хинон. [38]
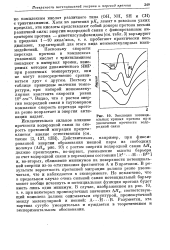 |
Эволюция потенциальных кривых протона пр и увеличении прочности водородной связи. [39] |
Действительно, например, при фиксированной энергии образования ионной пары из свободных молекул ( ДЯа, рис. 10) с ростом энергии водородной связи ДЯг должно происходить, во-первых, уменьшение высоты барьера за счет водородной связи в переходном состоянии [ А6 - Н - - В6 ] и, во-вторых, сближение минимумов на поверхности потенциальной энергии из-за стягивания фрагментов А и В протоном. В результате вероятность протонной миграции должна резко увеличиться, что и наблюдается в эксперименте. Не исключено, что в предельном случае очень сильной связи потенциальный барьер может вообще исчезнуть и потенциальная функция протона будет иметь лишь один минимум. Разумеется, эта картина сугубо умозрительна и нуждается в теоретическом и экспериментальном обосновании. [40]
Влияние заряда объясняет также и механизм, включающий образование ионной пары, сопровождающееся реакцией превращения внешнесферного комплекса во внутрисферный. Больший отрицательный заряд должен был бы увеличивать концентрацию ионной пары и, следовательно, полную скорость реакции анации. [41]
Кроме того, так как энергия, необходимая для образования ионной пары, в данном случае меньше, увеличивается электрический заряд, образующийся на 1 Мэв поглощенной энергии. Эти детекторы применяются в основном при спектроскопии сс-частиц, где необходима высокая разрешающая способность. [42]
Возможен, однако, более сложный вариант, включающий образование силикониевой ионной пары, которая, во-первых, подвергается быстрому обмену с обращением или сохранением конфигурации с равными скоростями и, во-вторых, превращается в исходные реагенты с сохранением конфигурации. [43]
Она в равной степени совместима с механизмом, включающим образование литий-карбанидной ионной пары, причем оптическая устойчивость циклопропильного аниона объясняется значительной величиной барьера для его инверсии. Помимо внутренне присущей этому циклическому карбаниону тенденции к пирамидальной структуре, существенно также то, что его инверсия в ионной паре должна приводить к разделению зарядов, что требует значительной энергии активации в растворителях с низкой диэлектрической проницаемостью. [44]
Отщепление галогена в случае хлорбензола может быть обусловлено процессом образования ионной пары. [45]
Страницы: 1 2 3 4