Образование - гальванические пары
Cтраница 2
Электрохимической коррозии подвержены участки ректификационных колонн, на которых возможны образование гальванических пар и возникновение коррозионного электрического тока. Такая коррозия, в частности, наблюдается в верхней части ректификационных колонн атмосферных установок для переработки нефти, где вместе с парами углеводородов интенсивно конденсируются водяные пары. Вода гидролизует содержащиеся в сырье и дистиллятах хлориды магния и кальция; получающийся в результате хлористый водород образует в водной среде электролит - соляную кислоту. [16]
Электрохимической коррозии подвержены участки ректификационных колонн, на которых возможны образование гальванических пар и возникновение коррозионного - электрического тока. [17]
Соединение шин к проводов из разных металлов должно исключать возможность образования гальванических пар. [18]
Соединение шин я проводов из разных металлов должно исключать возможность образования гальванических пар. [19]
Для сварного соединения наибольшее значение имеет электрохимическая коррозия, происходящая из-за образования гальванических пар и протекания электрического тока вследствие взаимодействия металла с электролитически проводящей средой. Различные зоны сварного соединения имеют на поверхности разные электрические потенциалы и вследствие этого могут выступать в роли микроэлементов. Такими микроэлементами являются сварной шов, зоны перегрева, перекристаллизации, максимальной пластической деформации и основной металл. Наибольшее влияние на скорость и распределение коррозионных процессов оказывает разница в химическом составе участков, образующих гальванические пары. В случае макропары, образованной сварным швом и основным металлом, усиленному разрушению подвергается шов, если он является анодом. [20]
Применять баки, изготовленные из совершенно однородного материала, во избежание образования гальванических пар, действие которых усиливает коррозию. Особое внимание необходимо уделять однородности химического состава стальной обечайки бака и сварных швов. [21]
В случае диффузионного или диффузионно-кинетического контроля вследствие неравнодоступности отдельных участков поверхности возможно образование гальванических пар неравномерной аэрации, анодом в которых является поверхность, к которой затруднен доступ кислорода. Примерами таких пар являются коррозия в щелях и зазорах ( щелевая коррозия), коррозия по ватерлинии. Для серебра и медных сплавов при неравномерной аэрации характерно проявление мотоэлектрического эффекта. [22]
Они сопровождаются электрохимическим осаждением на поверхности стали металлического Со или Ni и образованием гальванических пар железо - кобальт или железо - никель; при этом железо отдает кобальту или никелю свои валентные электроны, а последние передают эти электроны молекулярному кислороду или ионам Fe, и железо в виде Fe переходит в расплав. При этом происходит длительная коррозия поверхности стали, на которой появляются неровности, углубления. В последние проникает эмалевый грунтовый расплав, что и приводит к закреплению покрова на металле. [23]
При электрохимической коррозии на металл действуют различные электролиты, которые создают условия для образования гальванических пар и возникновения коррозионного электрического тока между отдельными участками внутренней поверхности колонны. Электрохимическая коррозия наблюдается на низкотемпературных участках корпуса и деталей колонны, особенно в самой верхней части, где при подаче острого орошения интенсивно конденсируются углеводородные и водяные пары. [24]
 |
Атмосферная станция на земле с двухярусными каркасами. [25] |
Очистка железа от ржавчины и окалины необходима уже потому, что их наличие на поверхности металла способствует образованию местных гальванических пар, являющихся первоисточником коррозии. [26]
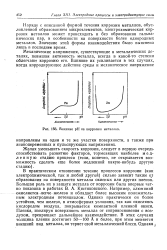 |
Влияние рН на коррозию металлов. [27] |
Наряду с описанной формой течения коррозии металлов, обусловленной образованием микроэлементов, электрохимическая коррозия металлов может происходить и без образования гальванических пар, в особенности на поверхности более однородных металлов. Значение этой формы взаимодействия было выяснено лишь в последнее время. [28]
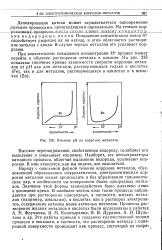 |
Влияние рН на коррозию металлов. [29] |
Наряду с описанной формой течения коррозии металлов, обусловленной образованием микроэлементов, электрохимическая коррозия металлов может происходить и без образования гальванических пар, в особенности на поверхности более однородных металлов. Значение этой формы взаимодействия было выяснено лишь в последнее время. В наиболее чистом виде такие процессы наблюдаются при растворении однородных, в частности, жидких металлов ( например, амальгам), в кислотах или в растворах электролитов, содержащих катионы менее активных металлов. [30]
Страницы: 1 2 3 4