Образование - перекись - водород
Cтраница 1
Образование перекиси водорода при самоокислении металлов происходит часто лишь тогда, когда металлы находятся в амальгамированном состоянии, как это было обнаружено для железа, никеля и олова. [1]
Образование перекиси водорода обнаружено в ряде ферментных и биологических систем, но лишь в том случае, когда система не содержит тяжелых металлов или ферментов каталазы и пероксидазы, которые обе разлагают перекись водорода. [2]
Образование перекиси водорода при самоокислении металлов сильно затрудняет проведение микроанализов, если они проводятся при доступе воздуха, и приводит к искажению их результатов. Так, при микроаналитическом определении железа этот элемент восстанавливают серебром. [3]
Образование перекиси водорода на металлах путем восстановления кислорода на катоде рассматривается ниже ( стр. [4]
Образование перекиси водорода в процессе окисления восстановленных ( лейко) антрахигюновых и антрахиноидных кубовых красителей изучено Этер-тэном и Тарнером [136], которые указывают, что перекись водорода может образоваться в качестве промежуточной стадии при окислении целлюлозы. Это окисление инициируется или ускоряется при изменениях системы красителей. [5]
Образование перекиси водорода при окислении пропана изучено значительно подробнее, чем при окислении других углеводородов. [6]
Образование перекиси водорода при фотохимической реакции окисления водорода, сенсибилизированной ртутью и протекаю: ной при комнатной температуре, подтверждается и другими исследованиями. Водородные атомы, образовавшиеся фотохимическим путем - при ударе второго рода с возбужденны ми ртутными атомами, - реагируют с кислородом с образованием преимущественно перекиси водорода. Квантовый выход последней зависит от температуры и составляет от 1 до 1 5 ( 1 2) молекулы на квант. Изменение температуры в пределах от 00 до 200, так же как изменение давления от J до J 1 ат, не влияет на выход перекиси водорода. С возрастанием концентрации кислорода до 1 7 % выход 11ЯО2 возрастает до 20 г / квт-ч Н2 () й, оставаясь затем постоянным. [7]
Образование перекиси водорода при реакции взаимодействия с кислотами характерно только для перекисей металлов. [8]
Образование перекиси водорода не создает никаких проблем в работе энергетических реакторов при повышенных температурах. [9]
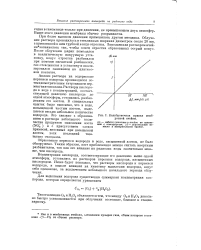 |
Калибровочная кривая мембранной ячейки. [10] |
Образование перекиси водорода в воде, насыщенной азотом, не было обнаружено. Таким образом, азот приближенно можно считать инертным разбавителем, так как его влияние на радиолиз воды значительно меньше, чем кислорода. [11]
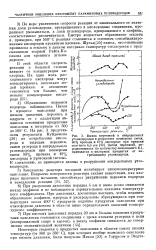
Образование перекиси водорода наблюдалось Пизом в процессе окисления при низком давлении, перекись и аддукты ее с альдегидом являются основными продуктами окисления в интервале от 300 до 500 С. На рис. 3 представлены результаты Куйджмена [30] по потреблению кислорода и выходам перекиси, окиси углерода и непредельных углеводородов при конверсии смеси 90 % пропана и 10 % кислорода в проточной системе. [13]
Образование перекиси водорода в условиях пламени считается мало вероятным. [14]
Образование перекиси водорода при действии молекулярного кислорода на сернистую кислоту давно установлено и никем не оспаривается. Таким образом, окисление сернистой кислоты молекулярным кислородом как под действием света, так и под действием окиси меди можно представить себе как цепную, разветвляющуюся ( согласно теории И. Н. Семенова) реакцию, не прибегая к помощи гидроксила, образование которого при обыкновенной температуре не доказано. [15]
Страницы: 1 2 3 4