Образование - пероксид - водород
Cтраница 1
Образование пероксида водорода изучено многими исследователями. Кольтгоф, Михан и Кимура [22] указывают, что в отсутствие кислорода пероксид не образуется; количество образующегося пероксида водорода одинаково, независимо от того, какой окислитель используют - MnOI, Ce v или бихромат; в отсутствие Мп образуется ничтожно малое количество Н2О2; количество образующегося Н202 увеличивается с уменьшением скорости добавления окислителя, при этом пероксида водорода образуется значительно больше, чем это соответствует добавленному окислителю. Авторы пришли к выводу, что окислитель взаимодействует с Мп, а образующийся при этом Мп111 дает с оксалатом комплекс. [1]
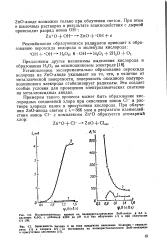
Установленное экспериментально образование пероксида водорода на ZnO-аноде указывает на то, что, в отличие от металлической поверхности, поверхность оксидного полупроводникового электрода стабилизирует радикалы. Это создает особые условия для проведения электрохимических синтезов на металлоксидных анодах. [3]
Возможно также образование пероксида водорода из гидрок-сильных радикалов. [4]
Максимальная скорость образования пероксида водорода в двухфазной системе ( католит предварительно насыщают кислородом) достигается при такой скорости протока, когда объем сжиженного слоя графита на 5 % превышает объем графитовой насадки без протока. [5]
Имеются указания на образование пероксида водорода при восстановлении атмосферного кислорода. Бердик [83] утверждает, что пероксид образуется только в том случае, если вместо кислоты в цинковом редукторе в качестве растворителя используют воду. Действительно, Лендел и Ноулз [84] показали, что пероксид полностью разрушается при восстановлении кислорода цинком в кислом растворе. Вместе с тем, Силл и Петерсон [85] обнаруживали образование пероксида водорода при быстром пропускании пузырьков воздуха через колонку с сильно амальгамированным цинком. При использовании свинцового редуктора образуются значительно большие количества пероксида. [6]
Непосредственно определить теплоту образования пероксида водорода из элементов не удается. [7]
Лучшие разультаты относительно скорости образования пероксида водорода достигнуты в трехфазной системе, когда через катодное пространство пропускают электролит, насыщенный кислородом, и одновременно в это же пространство подают кислород. [8]
Эти реакции и способствуют образованию пероксида водорода под действием 7 - пзлУчении в воде, содержащей растворенный кислород. [9]
Эти реакции и способствуют образованию пероксида водорода под действием у излУчении в воде, содержащей растворенный кислород. [10]
Дальнейшие превращения радикала НО2 снова приводят к образованию пероксида водорода. Допущение можно считать в данном случае физически вполне обоснованным. Равенство ( 31 отвечает прямой пропорциональности между объемной и поверхностной концентрациями водорода, что реализуется при малом заполнении поверхности адсорбированными частицами. Катодное восстановление кислорода отвечает этому условию, так как электродный потенциал в данном случае настолько далеко смещен в положительную сторону относительно потенциала обратимого водородного электрода, что поверхностная концентрация атомов водорода должна быть очень мала. [11]
Разлагается водой с выделением тепла и с образованием пероксида водорода. Поставляется в виде кусков, упакованных в металлические контейнеры, герметизированные с помощью сварки. [12]
Этим путем осуществляется окислительно-восстановительный цикл, приводящий к образованию пероксида водорода из молекулярного кислорода и водорода. По сравнению с электрохимическим синтезом пероксида водорода, при органических методах его производства расходуется гораздо меньше электроэнергии. Пероксид водорода широко применяется в медицине, в качестве отбеливающего средства, как промежуточный продукт органического синтеза ( получение органических пероксидов. [13]
Восстановленный кофермент ФАДНд окисляется далее кис, родом с образованием пероксида водорода и регенерат кофермента ФАД. [14]
 |
Константы скорости ( К парциальных реакций восстановления кислорода. [15] |
Страницы: 1 2 3