Образование - пероксид - водород
Cтраница 2
Он устойчив при анодной поляризации, а в катодном режиме полностью устраняет образование пероксида водорода. [16]
Образующийся неустойчивый молекулярный ион О2 - быстро присоединяет дополнительный электрон и протоны с образованием пероксида водорода. В щелочных растворах маршрут не изменяется, но из-за резкого снижения поляризации реакция практически становится обратимой ( Ь 0 03 В) - скорость ее определяется подводом кислорода к поверхности, и поляризация приобретает концентрационный характер. [17]
Электровосстановление кислорода - сложный многоэлектронный процесс, который может идти либо непосредственно до образования воды, либо через промежуточную стадию образования пероксида водорода. [18]
 |
Схема установки для дозирования гидразин-гидрата в трубопровод питательного насоса. [19] |
При низких значениях рН среды ( 7 0) гидразин не только не уменьшает кислородной коррозии стали, но даже усиливает ее вследствие образования пероксида водорода. [20]
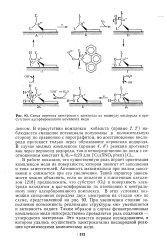 |
Схема переноса электронов с электрода на молекулу кислорода в присутствии адсорбированного комплекса меди. [21] |
В присутствии комплекса кобальта ( кривые 2, 2) наблюдается смещение потенциала полуволны в положительную сторону по сравнению с пирографитом, но восстановление кислорода протекает только через образование пероксида водорода. [22]
Схемы, в которых выделение кислорода протекает через промежуточное образование Н2О2 [125], являются весьма сомнительными, так как опыты, проведенные методом дискового электрода с кольцом, свидетельствуют об отсутствии образования пероксида водорода при анодном выделении кислорода на изотропном и анизотропном пироуглеродах. [23]
Для них характерно образование пероксида водорода с разбавленными растворами кислот, выделять кислород при действии воды и при термическом разложении. С горючими веществами они образуют пожаро - и взрывоопасные смеси. [24]
При малых заполнениях кислородом образуется только вода. При больших количествах кислорода реакция протекает с образованием пероксида водорода. При увеличении времени пребывания кислорода на поверхности угля наблюдается увеличение доли реакции, идущей до воды. [25]
Гидрирование проводят примерно до 50 % - ной степени конверсии хинона, что соответствует образованию более растворимого хин-гидрона, после чего раствор снова поступает на окисление. Этим путем осуществляется окислительно-восстановительный цикл, приводящий к образованию пероксида водорода из молекулярного кислорода и водорода. По сравнению с электрохимическим синтезом пероксида водорода, при органических методах его производства расходуется гораздо меньше электроэнергии. [26]
Гликолатоксидаза относится к флавиновым оксидазам и в качестве кофермента содержит флавинмононуклеотид. Перено-Сит электроны с субстрата непосредственно на молекулярный кислород с образованием пероксида водорода. [27]
Кроме этих органелл уже упоминались лизосомы - окруженные мембранами образования, содержащие набор гидролаз и обеспечивающие гидролитическое расщепление поступающих в клетку биополимеров. В отдельные структуры заключены ферменты, которые катализируют оксидазные реакции, приводящие к образованию пероксида водорода, и содержат каталазу для его уничтожения. [28]
Поскольку подобные соединения можно рассматривать как кислые соли пероксида водорода, их часто именуют гидро-пероксидами. Характерное свойство пероксидов металлов, пероксокислот и гид-ропероксидов - способность подвергаться гидролизу с образованием пероксида водорода и разлагаться, выделяя кислород, т.е. быть окислителями. [29]
При накоплении пероксида водорода потенциал электрода резко смещается в сторону отрицательных значений. Кроме того, увеличивается расход кислорода, так как электрохимический его эквивалент при образовании пероксида водорода в 2 раза выше. [30]
Страницы: 1 2 3