Образование - холодное пламя
Cтраница 2
В области низких температур рождению горячего пламени предшествуют несколько подготовительных стадий, в том числе образование холодного пламени. Для развития этих процессов необходимо соблюдение соответствующих концентрационных пределов реагирующих веществ, в том числе кислорода воздуха. [16]
 |
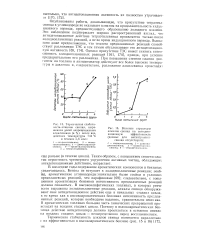
Пределы воспламенения перекиси этила. [17] |
В конце 30 - х годов имелись наблюдения, не совпадающие со взглядами М. Б. Неймана и по вопросу о механизме образования холодного пламени. Из них прежде всего следует указать на неудавшуюся попытку Гарриса и Эгертона [43] возбудить холодное пламя пропана добавкой диэтилперекиси в концентрации, являющейся при исследованной температуре критической для ее взрывного распада. [18]
Опубликованы работы, доказывающие, что присутствие тетраэтил-свинца в углеводороде не оказывает влияния на продолжительность индукционного периода, предшествующего образованию холодного пламени. Это наблюдение подтверждает широко распространенный взгляд, что антидетонационное действие тетраэтилсвинца проявляется только после холоднопламенных реакций, а не во время индукционного периода. Однако присутствие ТЭС может снизить интенсивность холоднопламенных реакций [161, 174], правда, при условии предварительного его разложения. [20]
После того как концентрациям превзойдет указанное критическое значение, начнется прогрессивное нарастание концентрации у, что и проявляется внешне в образовании холодного пламени. [21]
 |
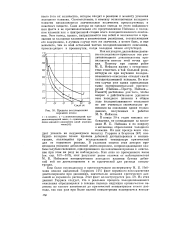
Изменение давления ( Р, dP / dt и свечения ( Л при воспламенении от сжатия смеси н. гептана с воздухом. а 2. [22] |
При этом были выбраны такие давление и температура сжатия ( рс 9 3 атм; Тс 400), при которых процесс завершается образованием только холодного пламени без горячего взрыва, как на осциллограммах а, рис. 89, что контролировали при помощи фотоумножителя и осциллографа визуальным наблюдением. [23]
При низких температурах и давлениях waw1 и так как в этом случае скорость окисления в первом приближении равна wz, то реакция приводит к образованию холодного пламени. В этих условиях скорость первой реакции юг настолько быстро растет со временем, что саморазогрев и последующее появление горячего пламени наступает задолго до образования критической концентрации перекисей. [24]
 |
Изменение давления ( Р, dP / dt и свечения ( Я при воспламенении от сжатия смеси. [25] |
При этом были выбраны такие давление и температура сжатия ( Рс - 9 3 атм; Тк 400), при которых процесс завершается образованием только холодного пламени без горячего взрыва, как на осциллограммах я, рис. 89, что контролировали при помощи фотоумножителя и осциллографа визуальным наблюдением. [26]
Следует отметить, что если факты, сообщенные Эгертоном и Гаррисом, не вызвали никакой реакции со стороны М. Б. Неймана, то гипотеза Ньюитта и Торнса о механизме образования холодного пламени встретила с его стороны настойчивое возражение. [27]
 |
Увеличение давления во время реакции пентана с кислородом. [28] |
Появление холодного пламени, сопровождающееся резким скачком давления, как показано на рис. 2, можно предотвратить путем понижения давления ниже некоторой критической величины при прочих неизменных условиях; при давлениях выше критического реакция, следующая за образованием холодного пламени, заканчивается взрывом ( появлением горячего пламени, что сопровождается резким повышением давления), который в случае богатых углеводородом смесей достигает значительной силы. Соответствующий пример приведен в табл. 1 на основании данных Неймана и Айвазова по изучению поведения смеси 1С5Н12 402 при давлении 340 мм рт. ст. и температуре 318 С. Первый ряд цифр обозначает время в секундах от начала опыта, а второй ряд - соответствующее увеличение давления в миллиметрах ртутного столба. [29]
Исследование такой же зависимости периода индукции холодного пламени от давления для 50 % - ной смеси пентана с кислородом ( Т 270 - 330 С) показало, что в этом случае при постепенном уменьшении давления наступает момент, когда прекращается образование холодных пламен. Ниже этого предельного давления идет медленная ( нехолодно-пламенная) реакция окисления. [30]
Страницы: 1 2 3 4