Образование - полуацеталь
Cтраница 3
Присоединение рпиртов часто происходит самопроизвольно ( экзотермическая реакция) и приводит к образованию полуацеталей. [31]
Присоединение спиртов часто происходит самопроизвольно ( экзотермическая реакция) и приводит к образованию полуацеталей. [32]
Имеющиеся данные свидетельствуют о значительной разнице в факторах, определяющих равновесие при образовании полуацеталя и ацеталя. [33]
Однако Трейбс и Дерра [473] предполагают, что этот синте протекает через стадию образования полуацеталя непределытог альдегида ( образующегося в результате взаимодействия с рас творителем, например метиловым спиртом) и, следовательно не является реакцией Михаэля. [34]
Этот случай кольчато-цепной таутомерии ближе к прототропии, чем к анионотропии, так как образование циклического полуацеталя II ( 2-окси - 5-метилтетрагидрофурана) происходит за счет перехода протона от гидроксильной группы у-окснвалералъд еги ца к кислороду его карбонильной группы. [35]
Наиболее часто в качестве стабилизатора применяется метанол, действие которого обусловлено, вероятно, образованием полуацеталей. Однако повышенное содержание метанола в формалине отрицательно сказывается на процессе конденсации формальдегида с другими альдегидами ( масляным, пропио-новым и др.) при получении многоатомных спиртов. Было показано, что при использовании формалина с содержанием метанола более: 35 6 - 7 % выход метриола снижается на и 25 10 % [73], поэтому перед применением формалина в реакции конденсации его f / s необходимо очистить от метанола. [36]
Переход из открытой формы в циклическую и название полуацетальная можно понять, если вспомнить реакцию образования полуацеталей при взаимодействии альдегида со спиртом ( стр. [37]
Поэтому кетон или карбкатион относительно стабилен по сравнению с соответствующим тетраэдрическим соединением: тенденция к образованию полуацеталей или циангидридов, а также к восстановлению мала. Наоборот, полуацетали имеют большие константы диссоциации, а 1-хлор - 2-метилциклопентан, циклопен-тилтозилат и родственные соединения сольволизуются с большой скоростью. [38]
Спирты, как и вода, обратимо присоединяются к оксосоедпнениям, преимущественно альдегидам, с образованием полуацеталей. В спиртовых растворах альдегидов полуацетали находятся в равновесии с карбонильными соединениями. [39]
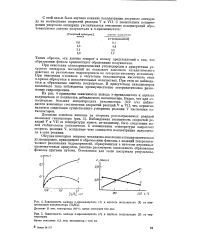 |
Зависимость выхода ге-крезилацетата ( 1 и ацетата полуацеталя ( 2 от температуры Время окисления 12 5 мин. катализатор - 0 36 г / л. [40] |
Таким образом, эти данные говорят в пользу представлений о том, что образованию фенола предшествует образование полуацеталя. [41]
Карбонильная группа моносахарида также может взаимодействовать с одной спиртовой группой ( пространственно наиболее близкой) с образованием полуацеталя. Но так как это реакция между разными функциональными группами одной молекулы, то в результате происходит внутримолекулярная перестройка и образование таутомерного гетероциклического полуацеталя. Оказалось, что такая форма молекулы более устойчива, чем ациклическая. [42]
Строение карбалкоксиметилстибинов доказано данными ИК - и ПМР-спектров, свидетельствующими, в частности, об отсутствии двойной связи, что исключает возможность образования изомерного 0-металлического производного полуацеталя кетена. [43]
Ожидалось, что выход продуктов типа ( I) будет снижаться при переходе от первичных к вторичным спиртам, так как способность последних к образованию полуацеталей менее выражена по сравнению с первыми. [44]
Оксиальдегиды окисляются относительно быстрее, если другая гидроксильная группа, находящаяся в положении у или б к карбонилу, допускает возникновение псевдогликольной структуры при образовании циклического полуацеталя. [45]
Страницы: 1 2 3 4