Образование - окисный слой
Cтраница 1
Образование изолирующего окисного слоя на алюминии имеет еще одно своеобразное применение. [1]
Первый период обжига, при котором происходит образование окисного слоя на поверхности металла, обычно заканчивается через 1 - 2 мин после начала обжига. Затем начинается второй период, при котором протекают процессы в расплавляющемся слое эмали и на границе железо-эмаль. При дальнейшем нагревании начинают плавиться соли, находившиеся в растворенном виде в шликере. Грунтовой слой спекается, а затем начинает оплавляться, причем постепенно снижается вязкость грунта. В этот момент прекращается свободный доступ кислорода к поверхности металла. [2]
Первый период обжига, при котором происходит образование окисного слоя на поверхности металла, обычно заканчивается через 1 - 2 мин. Далее начинается второй период, при котором протекают процессы в расплавляющемся слое эмали и на границе железо - эмаль. При дальнейшем нагревании начинают плавиться соли, находившиеся в растворенном виде в шликере. Грунтовой слой растекается, а затем начинает оплавляться. При этом постепенно снижается вязкость грунта. В этот момент уже прекращается свободный доступ кислорода к поверхности металла. [3]
В основе этого метода также лежит принцип образования плотного окисного слоя при анодной поляризации металла. Анодные окисные слои могут быть окрашены, чем достигается хороший декоративный вид изделий. Электрохимическое полирование также основано на способности металла пассивироваться. [4]
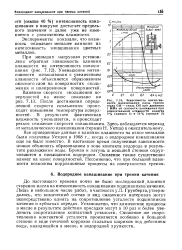 |
Зависимость интенсивности изнашивания пары трения сталь С45 - сталь С45 при давлении 1 МПа от скорости скольжения при относительной влажности воздуха 5 % ( кривая / и 50 % ( кривая 2. [5] |
Уменьшение интенсивности изнашивания с увеличением влажности объясняется образованием окисного слоя на поверхностях скольжения и полированием поверхностей. Влияние скорости скольжения поверхностей на износ показано на рис. 7.13. После достижения определенной скорости скольжения происходит повышение температуры поверхностей. [6]
Они защищают металлы и сплавы от окисления благодаря образованию плотного окисного слоя, основной составляющей которого является окись бериллия. [7]
Установлено, что довольно прочный спай можно получить, используя образование промежуточного окисного слоя. Окислы металла, покрывающие металл с поверхности, при сплавлении растворяются в стекле, образуется тонкий переходный цементирующий слой, состоящий из металла, его окиси и стекла. [8]
 |
Объяснение текст к. [9] |
Разложение карбонатов происходит в три стадии: I) нагрев без выделения СО2; 2) образование поверхностного окисного слоя с выделением СО. [10]
Особенно опасно присутствие на поверхности алюминия благородных металлов, так как, с одной стороны; нарушается равномерное образование защитного окисного слоя, с другой стороны, в случае доступа электролита это приводит к образованию местных элементов. Частицы посторонних металлов могут быть меха нически впрессованы в поверхность, загрязняя ее. Они могут так же привести к обогащению ее легирующими элементами. Равномерное распределение легирующих составляющих в меньшей степени понижает коррозионную стойкость. [11]
Особенно опасно присутствие на поверхности алюминия благородных металлов, так как, с одной стороны; нарушается равномерное образование защитного окисного слоя, с другой стороны, в случае доступа электролита это приводит к образованию местных элементов. Частицы посторонних металлов могут быть меха нически впрессованы в поверхность, загрязняя ее. Они могут так же привести к обогащению ее легирующими элементами. Равномерное распределение легирующих составляющих в меньшей степени понижает коррозионную стойкость. [12]
Особый интерес представляют конфигурации кислородных комплексов при заполнениях меньше монослоя, так как понимание природы поверхностных комплексов является необходимым для выяснения механизма образования окисного слоя. [13]
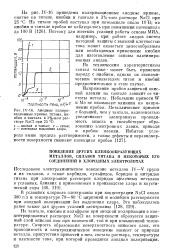 |
Анодные поляризационные кривые титана, ниобия и тантала в 3 % - иом растворе NaCl при 25 С. 1 - ниобий и тантал. г - титан. 3 - потенциал выделения хлора. [14] |
На тантале, ниобии и вольфраме при анодной поляризации в концентрированных растворах NaCl на поверхности образуется защитный слой окислов как при комнатной, так и при повышенной температуре. Скорость образования поверхностного окисного слоя, его проводимость и электрохимическое поведение зависят от природы металла, присутствия примесей в нем, состава раствора, температуры и плотности тока, при которой проводится анодная поляризация. [15]
Страницы: 1 2 3