Образование - экстрагируемое соединение
Cтраница 3
Реальный процесс экстракции вещества из водной фазы, несомненно, более сложен. Предположим, что реакция образования экстрагируемого соединения имеет место в водной фазе. [31]
Следует подчеркнуть, что селективность этих экстрагентов для щелочных металлов не связана с какими-либо специфическими свойствами фенолов, проявляемыми по отношению именно к этим металлам. Щелочные металлы селективно извлекаются не вследствие образования особо прочных экстрагируемых соединений или других особенностей экстракционных равновесий, а потому только, что экстракция возможна из щелочных растворов, в которых большинство катионов образует труднорастворимые осадки гидроокисей или, как это имело место в работе [4], существует в виде анионных комплексов в присутствии комплексообразователя. Кстати, в этой же работе показано, что. [32]
Зависимость типа А характерна для систем, в которых образуются очень прочные комплексы катионов металла с анионами-лигандами, зависимость типа Б - для менее прочных комплексов и типа В - для тех комплексов, которые образуются только при наиболее высоких концентрациях анионов-лигандов. Зависимость типа Г характерна для элементов, для образования экстрагируемых соединений которых необходимы такие высокие концентрации анионов-лигандов, что присутствие последних в виде кислоты приводит к полному связыванию соли амина кислотой и к подавлению экстракции соли металла. Поэтому эти элементы могут извлекаться только при концентрациях анионов-лигандов 6 - 8 М и более в сочетании с почти полным отсутствием соответствующей кислоты в растворе. Коэффициенты распределения этих элементов резко уменьшаются при увеличении концентрации кислоты выше 10 - 2 М и растут при приближении концентрации аниона-лиганда в водной фазе к насыщению. [33]
Оказалось [180], что степень насыщения экстр-агента цирконием в зависимости от времени контакта фаз проходит через максимум. Это, по мнению авторов, связано с двухстадийным механизмом образования экстрагируемого соединения. [34]
Количественное описание экстракции внутрикомплекс-ных соединений, рассмотренное в предыдущих разделах главы, основано на допущении, что органическая и водная фазы находятся в равновесии. Скорость достижения равновесия зависит от двух факторов: 1) скорости образования экстрагируемых соединений и 2) скорости переноса различных соединений из одной фазы в другую. [35]
Значительное влияние на коэффициенты распределения оказывает и концентрация водородных ионов в водных растворах. При экстракции кислородсодержащими органическими растворителями это влияние обусловлено участием ионов водорода в образовании экстрагируемого соединения, а также связыванием части экстрагента в соединение с кислотой. Изменение рН водного раствора может менять и равновесную концентрацию анионов, входящих в состав экстрагируемой соли в случае анионов слабых кислот. [36]
Вследствие слабой кислотной диссоциации молекул фенолов HR экстракции металлов этими экстрагентами из кислых и нейтральных растворов не происходит. Добавление в систему щелочи приводит к сдвигу равновесия ( 1) в сторону образования экстрагируемого соединения. [37]
Учет влияния химических реакций на массопередачу через фактор ускорения при экстракции неорганических веществ не нашел, однако, распространения прежде всего потому, что рассчитанные значения Е не поддаются простой экспериментальной проверке. Действительно, для этого необходимо было бы экспериментально определить скорость экстракции без химической реакции образования экстрагируемого соединения, а это, как правило, невозможно. [38]
Диффузионные ячейки с перемешиванием неперспективны для исследования кинетики гомогенных реакций при экстракции. Ранее Хонакер и Фрейзер [112] показали, что скорость экстракции Zn ограничивается протеканием медленных химических реакций образования экстрагируемого соединения в водной фазе. Выводы Хонакера и Фрейзера, естественно, не могли быть подтверждены в работе [87] с помощью метода диффузионных ячеек с перемешиванием. [39]
Влияние концентрации водородных ионов в исходном растворе проявляется двояким образом. При изменении рН раствора может меняться концентрация анионов, входящих в состав экстрагируемого сольвата; рН среды особенно сильно-влияет на Ка, когда применяют комплексообразование для экстракционного разделения элементов. С другой стороны, ионы водорода участвуют в образовании экстрагируемых соединений с экстрагентом. [40]
Экстракция включает различные химические реакции и перенос массы через поверхность раздела жидкость - жидкость. Скорость экстракции определяется скоростью наиболее медленного процесса: либо массопередачи, либо химической реакции. Если в реакции участвуют кинетически инертные комплексы, то образование экстрагируемого соединения может протекать очень медленно, что и наблюдается для комплексов Fe ( III), Mn ( III), Co ( lII), Cr ( III) и др. Если в скорости экстракции разделяемых ионов наблюдаются достаточно большие различия, то эти ионы могут быть разделены с большой эффективностью независимо от соотношения количественных характеристик распределения. Таким образом, высокая эффективность и селективность экстракции может быть обеспечена соответствующим выбором условий, например рН, концентрации реагента, растворителя, введением маскирующих веществ и даже различием в скорости экстракции. [41]
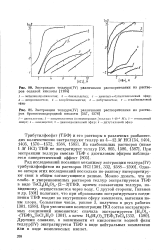 |
Экстракция теллура ( ТУ различными растворителями из растворов соляной кислоты.| Экстракция теллура ( ГУ различными растворителями из растворов бромистоводородной кислоты. [42] |
Однако авторы этих исследований несколько по-разному интерпретируют свои в общем согласующиеся данные. Можно думать, что из слабо - и умереннокислых растворов теллур экстрагируется ТБФ в виде ТеС14 ( Н20) 2 ( 2 - 3) ТБФ, причем сольватация теллура, по-видимому, осуществляется через воду. С другой стороны, Гиганов и др. [301] полагают, что при образовании экстрагируемого соединения ТБФ входит во внутреннюю сферу комплекса, вытесняя ионы хлора. Другими словами, в зависимости от кислотности водной фазы теллур ( 1У) экстрагируется ТБФ в виде нейтральных комплексов или в виде комплексных кислот. [43]
Анализируя уравнения (5.21), (5.27) и (5.28), можно выяснить, как влияют различные факторы на величины / Ср указанных элементов. Прежде всего, величина Л р зависит от константы экстракции К. На величину / Ср влияют также концентрации экстрагента и всех веществ, участвующих в образовании экстрагируемого соединения. [44]
Приведенными примерами практически исчерпывается перечень работ, посвященных экстракции нещелочных металлов, когда процесс в основном обусловлен взаимодействием катиона металла ( возможно, гидратированного) и фенолят-иона без образования прочных хелатов. В литературе, однако, имеется значительное число исследований по комплексообразованию различных металлов с одно - и многоатомными фенолами в водных и органических растворах. Иногда могут быть созданы условия, когда такие комплексы будут экстрагироваться в органическую фазу с образованием сложных экстрагируемых соединений. [45]
Страницы: 1 2 3 4