Образование - соль - кислота
Cтраница 2
Высокие значения рН в верхнем отделе кишечника ( 8 0 - 8 5) способствуют образованию солей хрлевых кислот, являющихся исключительно хорошими эмульгаторами. Перистальтические движения кишечника оказывают-диспергирующее действие; получающаяся высокодисперсная прямая эмульсия всасывается через стенки тонких кишок и поступает в лимфу и кровь. [16]
На первой стадии 1 моль s - дифенилгуанидина реагировал с 1 молем бензолфосфоновой кислоты с образованием соли дифенилгуанидинмонобензолфосфоновой кислоты, причем дифенилгуа-нидин действует как однокислотное основание. [17]
Может также происходить гидролиз тиотреххлористого фосфора, алкилдихлортиофосфата и диалкилхлортиофосфата в присутствии избытка щелочи, приводящей к образованию солей тиофос-форных кислот. В связи с изложенным выбор условий получения того или иного эфира хлортиофосфорной кислоты должен производиться с учетом скоростей основных и побочных реакции. [18]
Подобно ионным циклопентадиенидам щелочных металлов, манганоцен легко гидролизуется до циклопентадиена и гидроокиси металла и реагирует с СО2 с образованием солей цикло-пентадиенкарбоновой кислоты. [19]
Авторы считают, что механизм полимеризации капролактама в этом случае отличается от гидролитического только первой стадией, заключающейся в образовании соли инициирующей кислоты с лактамом. [20]
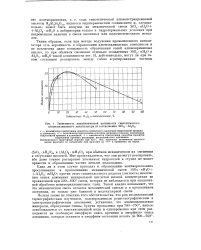 |
Зависимость каталитической активности синтетического алюмосиликатного катализатора от соотношения Si02. А1203. [21] |
Таким образом, если при методе получения промышленного катализатора есть вероятность в образовании алюмосиликатных комплексов и не исключена даже возможность образования солей алюмокремневых кислот, то при обычном смешении отдельно осажденных Si02 / гН20 и А1203 тН20 такой возможности нет. [22]
Однако в этих работах не приводятся аналитические данные, подтверждающие, что серный ангидрид не взаимодействует с нитрильной группой. Представляется возможным при взаимодействии циклических N-сульфонатов с избытком S03 образование соли соответствующей а-сульфоновой кислоты при проведении послереакционной обработки в водной среде. [23]
Образование N - и О-алкилпроизводных изатина было уже обсуждено в связи с вопросом о таутомерии изатина. Алкилизатины представляют собой довольно устойчивые вещества, растворяющиеся в щелочи с образованием солей N-алкилизатиновой кислоты, из которых при подкислении снова выделяется 1-алкилизатин. С другой стороны, при подкислении щелочных растворов О-алкилпроизводных выделение изатина сопровождается потерей алкильной группы. [24]
Определение основано на реакции нитратов с салицилатом натрия в концентрированной трихлоруксусной кислоте с образованием соли нитросалици-ловой кислоты, окрашенной в желтый цвет. В присутствии трихлоруксусной кислоты устраняются мешающие влияния неустойчивых органических веществ. [25]
Они показали, что катализаторами процесса поликонденсации эфиров а-аминокислот являются вещества кислого характера - ССЬ, соляная кислота, серная, уксусная, полиглицин, поли-аланин, аминоэнантовая, а также вода. Каталитическое действие кислот авторы связывают с активированием эфирной связи Н - ионом, а ССЬ - с образованием соли замещенной карбами-новой кислоты. Действие воды объясняется легкой омыляе-мостью эфирных групп полимера до карбоксильных, которые и являются катализаторами. [26]
Щелочным раствором пикрата калия или натрия обрабатывают полоски фильтровальной бумаги, которые окрашиваются в желтый, цвет. При экспонировании на воздухе в присутствии цианистого водорода окраска индикаторной бумажки изменяет цвет от желтого к красному в результате образования соли ызо-пурпу-ровой кислоты. Мешают определению все восстановители. [27]
Кинетика гидролиза сложных эфиров очень сложна, так как приходится учитывать и каталитическое действие получающейся при гидролизе кислоты. При кислотном гидролизе реакции не доходят до конца, оставаясь всегда в каком-то состоянии равновесия, и лишь при щелочном гидролизе благодаря образованию солей кислот реакция проходит количественно. [28]
Гидрат окиси железа Fe ( OH) 3 обладает очень слабо выраженными основными и еще более слабыми кислотными свойствами. Он нерастворим в воде, но легко образует в ней коллоидные растворы; хорошо растворяется в кислотах, а свежеполученный частично растворим также в горячих концентрированных растворах сильных щелочей с образованием солей железистой кислоты HFeO2, называемых ферритами. [29]
Гидрат окиси железа Fe ( OH), обладает очень слабо выраженными основными и еще более слабыми кислотными свойствами. Он нерастворим в воде, но легко образует в ней коллоидные растворы; хорошо растворяется в кислотах, а свежеполученный частично растворим также в горячих концентрированных растворах сильных щелочей с образованием солей железистой кислоты HFeO2, называемых ферритами. [30]
Страницы: 1 2 3