Образование - сульфит
Cтраница 3
 |
Структурная схема зерна. [31] |
Индексы: 0 - входная и неизменная величина; / - вещество ( 1 - сода; 2 - сульфит натрия; 3 - пиросульфит натрия; 4 - сернистый ангидрид); i - секция; s - номер реакции ( 1 - образование сульфита натрия; 2 - образование пиросульфита натрия); см - смесь; и - избыточное количество; в - вещество на выходе из реактора. [32]
 |
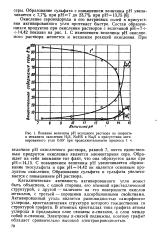
Влияние величины рН исходного раствора на скорость и механизм окисления H2S, NaHS и Na2S в присутствии активированного угля БАУ при продолжительности процесса 1 ч. [33] |
С повышением величины рН увеличивается образование тиосульфата и при рН 14 42 он является основным продуктом окисления. Образование сульфита и сульфата увеличивается с повышением рН раствора. [34]
 |
Влияние величины рН исходного раствора на скорость и механизм окисления H2S, NaHS и Na2S в присутствии активированного угля БАУ при продолжительности процесса 1 ч. [35] |
С повышением величины рН увеличивается образование тиосульфата и при рН 14 42 он является основным продуктом окисления. Образование сульфита и сульфата увеличивается с повышением рН раствора. [36]
Растворы Na2S2O4 при нагревании нестабильны и быстро окисляются кислородом. Разложение с образованием сульфита и тиосульфата ускоряется с повышением температуры. О влиянии концентрации раствора данные противоречивы. Добавление 1 % NaOH или Na2CO3 значительно повышает стабильность [ 5, с. При окислении раствора Na2S2O4 на воздухе образуется Н2О2, обнаруживаемая чувствительными методами. [37]
Процесс состоит из стадий абсорбции, восстановления и регенерации абсорбента. Абсорбция SOz производится карбонатами с образованием сульфитов и сульфатов металлов. Скорости реакций очень велики, поэтому процесс лимитируется скоростью переноса диоксида серы. Абсорбцию проводят в оросительном скруббере при скорости газа 7 5 м / с. Реакции, проходящие в скруббере, экзотермичны, что позволяет частично компенсировать потерю тепла. [38]
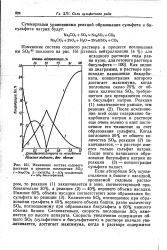 |
Изменение состава содового раствора в процессе поглощения SO2. [39] |
Если абсорбция SO2 осуществляется в башне с насадкой, орошаемой содовым раствором, то реакция ( 1) заканчивается в зоне, соответствующей приблизительно 30 %, а реакция ( 2) - 40 % верхнего объема насадки. Количество SOg, поглощаемое при образовании сульфита в 40 % верхнего объема башни, равно количеству SO2, поглощаемому при образовании бисульфита в 60 % нижнего объема башни. Следовательно, скорость поглощения SOz изменяется по высоте аппарата. [40]
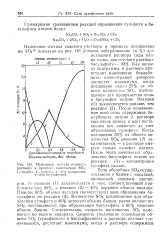 |
Изменение состава содового. [41] |
Если абсорбция SOa осуществляется в башне с насадкой, орошаемой содовым раствором, то реакция ( 1) заканчивается в зоне, соответствующей приблизительно 30 %, а реакция ( 2) - 40 % верхнего объема насадки. Количество SO2, поглощаемое при образовании сульфита в 40 % верхнего объема башни, равно количеству S02, поглощаемому при образовании бисульфита в 60 % нижнего объема башни. Следовательно, скорость поглощения SO2 изменяется по высоте аппарата. [42]
Если абсорбция SO2 осуществляется в башне с насадкой, орошаемой содовым раствором, то реакция ( 1) заканчивается в зоне, соответствующей приблизительно 30 %, а реакция ( 2) - - 40 % верхнего объема насадки. Количество SO2, поглощаемое при образовании сульфита в 40 %; верхнего объема башни, равно количеству SO2, поглощаемому при образовании бисульфита в 60 % нижнего объема башни. Следовательно, скорость поглощения SO2 изменяется по высоте аппарата. [43]
По этому способу газообразный аммиак впрыскивают непосредственно в очищаемые от SO2 газы до поступления их на установку обезвреживания. При этом SO2 реагирует с аммиаком в газовой фазе с образованием сульфита и бисульфита аммония. Далее газы направляют в два последовательно установленных абсорбера, орошаемых раствором сульфит-бисульфата аммония, в которых улавливаются образовавшиеся сульфоаммиачные продукты. Избыток раствора из абсорбера направляют в реактор, в который одновременно подают острый пар и известковое молоко. [44]
Растворы тиосульфатов следует готовить на воде, не содержащей примесей тяжелых металлов, во избежание каталитического окисления кислородом воздуха. Обычное окисление кислородом воздуха протекает крайне медленно и вызывает постепенное разложение тиосульфата и образование сульфита, который, в свою очередь, быстро окисляется воздухом до сульфата. [45]
Страницы: 1 2 3 4