Образование - сульфит
Cтраница 4
Каталитическое воздействие на образование SO3 оказывает также слой золы при температуре примерно 600 С. При наличии оксидов серы в газах происходит соединение их со щелочными компонентами золы и образование сульфитов, которые разрушающе действуют на защитную пленку окалины. [46]
 |
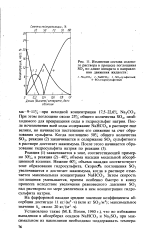
Мокрый золоуловитель с коагулятором Вентури. [47] |
В мокрых золоуловителях помимо улавливания золы протекают химические процессы поглощения из дымовых газов оксидов углерода и серы. Образующаяся сернистая кислота, взаимодействуя с солями жесткости воды и со щелочами золы, приводит к образованию сульфита кальция CaSO3, вследствие чего возможно забивание элементов золоуловителя отложениями. При большой жесткости смывной воды ( более 20 мг экв / л), а также для некоторых топлив, в золе которых содержится более 20 % ( по другим данным более 15 %) оксида кальция СаО или более 1 % свободной извести, применение мокрых золоуловителей недопустимо. [48]
 |
Мокрый золоуловитель с коагулятором Вентури. [49] |
В мокрых золоуловителях помимо улавливания золы протекают химические процессы поглощения из дымовых газов оксидов углерода и серы. Образующаяся сернистая кислота, взаимодействуя с солями жесткости воды и со щелочами золы, приводит к образованию сульфита кальция CaSO3, вследствие чего возможно забивание элементов золоуловителя отложениями. При большой жесткости смывной воды ( более 20 мг экв / л), а также для некоторых топлив, в золе которых содержится более 20 % ( по другим данным более 15 %) оксида кальция СаО или более 1 % свободной извести, применение мокрых золоуловителей недопустимо. [50]
 |
Изменение состава содового раствора в процессе поглощения SO2 по длине аппарата в направлении движения жидкости. [51] |
При этом поглощено около 25 % общего количества SO2, необходимого для превращения соды в гидросульфит натрия. После исчезновения всей соды содержание NaHCO3 в растворе еще велико, но начинается постепенное его снижение за счет образования сульфита. Когда поглощено 50 % общего количества SO2, реакция ( 2) заканчивается и содержание SO2 сульфитного в растворе достигает максимума. [52]
Как видно из диаграммы, в растворе происходит накопление бикарбоната, концентрация которого достигает максимума, когда поглощено около 25 % от общего количества SO2, требующегося для превращения соды в бисульфит натрия. После исчезновения всей соды содержание бикарбоната натрия в растворе еще очень велико и идет постепенное его снижение за счет образования сульфита. Когда поглощено 50 % от общего количества SO2, реакция ( 2) заканчивается, - в растворе имеется только сульфит натрия. [53]
Как видно из диаграммы, в растворе происходит накопление бикарбоната, концентрация которого достигает максимума, когда поглощено около 25 % от общего количества S Cb, требующегося для превращения соды в бисульфит натрия. После исчезновения всей соды содержание бикарбоната натрия в растворе еще очень велико и идет постепенное его снижение за счет образования сульфита. Когда поглощено 50 % от общего количества SOs, реакция ( 2) заканчивается - в растворе имеется только сульфит натрия. [54]
Как видно из диаграммы, в растворе происходит накопление бикарбоната, концентрация которого достигает максимума, когда поглощено около 25 % от общего количества SO2, требующегося для превращения соды в бисульфит натрия. После исчезновения всей соды содержание бикарбоната натрия в растворе еще очень велико и идет постепенное его снижение за счет образования сульфита. Когда поглощено 50 % от общего количества SO2, реакция ( 2) заканчивается, - в растворе имеется только сульфит натрия. После этого начинается образование бисульфита натрия по реакции ( 3) - концентрация сульфита падает. [55]
В самом деле, трудно ввести во взаимодействие металлический калий, серу и кислород, чтобы при этом получился чистый сульфит калия, да еще провести реакцию так, чтобы можно было определить изменение энтальпии. Если для всех этих процессов изменения энтальпии известны, то по ним можно рассчитать и изменение энтальпии при гипотетической реакции образования сульфита калия из металлического калия, серы ( ромбической) и кислорода. Зависимость конечной величины от значительного числа исходных величин требует, чтобы каждая из них была определена с соответствующей точностью. При этом обычно нужно знать еще теплоемкости соответствующих веществ и растворов и изменение энтальпии при изменении концентрации этих растворов. [56]
Первую стадию проводят под давлением 3 - 4 МПа при 470 - 670 К, вторую при 370 - 470 К, третью - при 1070 К. Согласно этому предложению, при 470 - 670 К и давлении 3 - 4 МПа оксиды металлов ( МО) взаимодействуют с SO2 с образованием сульфитов. В результате взаимодействия с водяным паром на втором этапе цикла сульфит металла конвертируется в сульфат с выделением водорода. Смесь эта легко разделяется, SO2 возвращают в цикл, а О2 отводят в качестве одного из целевых продуктов процесса. Для обеспечения непрерывности получения продуктов и повышения экономичности процесса его осуществляют в периодически переключающихся реакторах, снабженных устройствами для рекуперации тепла или на основе непрерывного процесса. [57]
Предложенный механизм перегруппировки Богданова не имеет пока экспериментальных подтверждений, но может быть полезен в качестве рабочей гипотезы. Например, с точки зрения высказанных положений, а-изомеры 3 4-дигидро - 1 2-фуроксан - 4-сульфо-кислот ( LVI) в отличие от - изомеров ( XXXVI) должны вести себя как обычные бисульфитные соединения, не подвергаться перегруппировке, а разрушаться щелочами с образованием сульфита и соответствующего ароматического фуроксана. [58]
Одни исследователи считают, что эти превращения происходят по схеме R - SO3H - - R - SH - - RH - f NiS. Промежуточный продукт ( меркаптан) адсорбируется на катоде и влияет на катодный процесс никелирования. В соответствии с другой концепцией на поверхности катода происходит десульфирование сульфосоединений с образованием сульфита, который затем восстанавливается до иона сульфида по схеме R - SO3H - - RH - f - SOg - S2Og - - NiS. Обе схемы предполагают одинаковые конечные продукты и различаются промежуточными стадиями. [59]
Удаление серосодержащих отходов - - проблема, аналогичная удалению галогеноорганических отходов. При сжигании серосодержащих отходов сера окисляется до сернистого ангидрида, а при достаточном избытке воздуха - до серного ангидрида. Оба эти окисла могут абсорбироваться в насадочной колонне раствором каустической или кальцинированной соды с образованием сульфита или бисульфита натрия. Другим способом удаления серы служит впрыск в зону горения водного раствора каустической или кальцинированной соды. [60]
Страницы: 1 2 3 4