Образование - хромит
Cтраница 1
Образование хромита является неизбежным во всех тех случаях, когда в системе имеются окись хрома и закись железа. [1]
Образование хромита кальция при прокаливании шихты, состоящей из хромата натрия и окиси кальция, в присутствии восстановителя не происходит. В этих условиях образуется хромит натрия, а окись кальция остается в свободном состоянии. [2]
Ряд исследователей опровергает возможность образования двух-кальциевого хромита. Васенин [2] на основании термического метода анализа пришел к выводу, что при прокаливании смеси СаО и Сг2О3 на воздухе только при двух соотношениях ( 1: 1 и 3: 1) получаются спеки с определенной кристаллической структурой. [3]
Дерен и Габер [4, 5] изучили образование хромита магния MgCr204 в результате твердофазовых реакций. [5]
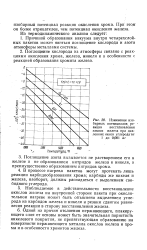
Полученные значения величин изобарных потенциалов указывают на возможность образования хромита кальция из хромата натрия в присутствии восстановителя и окиси кальция, однако образование хромита натрия более вероятно. [6]
По данным Б. П. Селиванова, А. С. Гинсберга и М. М. Воровича [1], причиной, вызывающей загустева-ние хромистых мартеновских шлаков, является образование хромита. При этом образование хромита неизбежно во всех тех случаях, когда в системе имеются окись хрома и закись железа. [7]
 |
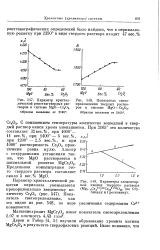
Изменение изобарных потенциалов реакции восстановления закиси железа при давлениях окиси углерода от I до 0 001 ат. [8] |
Поглощение кислорода из атмосферы связано с реакциями окисления хрома, железа, никеля и в особенности с реакцией образования хромита железа. [9]
Полученные значения величин изобарных потенциалов указывают на возможность образования хромита кальция из хромата натрия в присутствии восстановителя и окиси кальция, однако образование хромита натрия более вероятно. [10]
На это обстоятельство впервые обращено внимание в работе [21], в которой коэффициент диффузии ионов хрома в № Сг2О4 рассчитан по величине рациональной константы скорости реакции образования хромита никеля. [11]
Едкие щелочи при осторожном прибавлении к раствору соли Gr ( III) выделяют серо-зеленый осадок Сг ( ОН) 3, растворимый в избытке осадителя с образованием хромитов ярко-зеленого цвета. Аммиак выделяет студенистый осадок Сг ( ОН) 3, немного растворимый в избытке реактива в присутствии NH4G1 с образованием соли CrCl3 ( NH3) 6 фиолетового цвета. Гидрофосфат натрия выделяет из нейтральных или уксуснокислых растворов, буферированных ацетатом натрия, зеленый аморфный осадок СгР04, растворимый в минеральных кислотах и щелочах. В присутствии щавелевой, винной, лимонной кислот, глицерина и ряда других органических соединений гидроокись и фосфат хрома не осаждаются. [12]
Несмотря на слабо выраженную амфотерность, соединения хрома ( 3) типа хромитов необычайно важны в технике. При образовании хромитов железа и никеля получаются кристаллы кубической системы - шпинели, обладающие высокой химической устойчивостью. [13]
Несмотря на слабо выраженную амфотерность, соединения хрома ( 3) типа хромитов необычайно важны в технике. При образовании хромитов железа и никеля получаются кристаллы кубической системы - шпинели, обладающие высокой химической устойчивостью. [14]
Несмотря на слабо выраженную амфотерность, соединения хрома ( 3) типа хромитов необычайно важны в технике. При образовании хромитов железа и никеля получаются кристаллы кубической системы - шпинели, обладающие высокой химической устойчивостью. [15]
Страницы: 1 2 3