Образование - хромит
Cтраница 3
Серо-зеленый или серо-голубой аморфный порошок, пл. Выше 100 С разлагается на Сг303 и воду, далее масса раскаляется, окрашивается в темно-зеленый цвет и теряет способность растворяться в кислотах. Нерастворим в воде ( ПР6 3 - 10 - 31), растворяется в растворах щелочей с образованием хромитов. Обладает амфотерными свойствами и может вести себя как очень слабая кислота НСг02 [ Сг ( ОН) 3 - Н20 ] с константой диссоциации 910 ] 6 при 25 С. [31]
Серо-зеленый или серо-голубой аморфный порошок, пл. Обычно получаемый продукт сильно гидратирован и отвечает формуле Сг ( ОН) 3 - пН2О ( и 2 н - 4); при выдерживании над конц. Выше 100 С разлагается на Сг203 и воду, далее масса раскаляется, окрашивается в темно-зеленый цвет и теряет способность растворяться в кислотах. Нерастворим в воде ( ПР6 3 - 10 - 31), растворяется в растворах щелочей с образованием хромитов. Обладает амфотерными свойствами и может вести себя как очень слабая кислота НСг02 [ Сг ( ОН) 3 - Н20 ] с константой диссоциации 9 - Ю 16 при 25 С. [32]
Эффект реакций окисления железа и хрома при нагреве пакетов усиливается дополнительно развивающейся реакцией взаимодействия между продуктами окисления этих двух металлов. Образующиеся при - этом кристаллы хромита имеют характерный голубовато-зеленоватый оттенок. Как видно из рис. 26, прямая, изображающая зависимость AZr f ( F) pe -, акции образования хромитов железа из элементов, расположена почти параллельно аналогичной прямой для окисления хрома и имеет почти ту же степень вероятности. По своей абсолютной величине изобарные потенциалы этих двух реакций намного превышают остальные, из чего следует, что в рассматриваемой системе эти две реакции должны получить преимущественное развитие. Протекание этих двух реакций должно привести к полному поглощению кислорода воздуха, оставшегося в зазорах между пластинами и стенками пакета. [33]
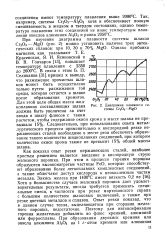 |
Диаграмма плавкости системы Сг2О3 - MgO. [34] |
Однако прибавка магнезии, как указывают Т. Е. Красенская, Я. И. Ясиновский и С В. Гончаров [13], повышает еоии температуру плавления с 2350 2700 до 2600 С. В связи с этим Б. П. Селиванов [31] пришел к выводу, 2600 что разжижение хромистых шла-ков может быть осуществлено только путем разжижения той 2Ш среды, которая остается в шлаке после образования хромитов. [35]
Отделение шлака от жидкого металла в мартеновской печи обеспечивается различием их удельных весов. Однако для успешного осуществления этой задачи необходимо, чтобы шлаки находились в жидкоподвижном состоянии. Поэтому, если в исходных шихтовых материалах недостает каких-либо окислов для получения достаточно легкоплавких шлаков, то обычно вводят эти окислы в шихту в виде флюсов. Следовательно, чтобы получить каче - ственную поверхность реза и сделать процесс резки нержавеющих сталей экономичным, необходимо, исходя из опыта мартеновского производства, выбрать такой состав флюса, который, будучи введенным в реакционную зону, образовал бы шлаки требуемой вязкости и температуры плавления. Известно, что в установившейся металлургической практике не вызывают затруднений шлаки, содержание окиси хрома в которых не превышает 6 - 7 %, но уже при введении в мартеновский шлак свыше 10 % окиси хрома происходит загустевание этих шлаков, которое развивается, несмотря на общее повышение температуры в печи. Образование хромита является неизбежным во всех тех случаях, когда в системе имеется окись хрома и закись железа. [36]
При обычных температурах не взаимодействует с воздухом и с водой. При обычных условиях растворяется в разбавленных соляной и серной кислотах. Взаимодействует при температуре красного каления с водяным паром, вытесняя водород. Наиболее типичны соединения шестивалентного хрома. Хромовый ангидрид СгО3 легко растворяется в воде, образуя хромовую кислоту. Хромовый ангидрид ядовит и является очень сильным окислителем. Окись хрома Сг2О3 образуется при непосредственном взаимодействии хрома и кислорода при нагревании. Не растворяется ни в воде, ни в кислотах. При действии щелочей на соли трехвалентного хрома образуется гидрат окиси хрома - соединение, обладающее амфотерными свойствами, растворимое в кислотах, а также в щелочах с образованием хромитов. Широко применяется в производстве сталей как легирующий элемент. [37]
Страницы: 1 2 3