Образование - циклогексанон
Cтраница 1
Образование циклогексанона возможно в том случае, если к фенолу присоединяется лишь 2 моль водорода, при этом промежуточно образующийся циклогексенол изомеризуется в циклический кетон. [1]
Изучение кинетики распада гидроперекиси цпклогекспла и образования циклогексанона позволило установить, что циклогексанон образуется главным образом в результате непосредственного распада гидро-перекисного радикала. [2]
Конформации, которая привела бы к образованию циклогексанона, по-видимому, не существует, так как она должна быть очень неустойчивой; поэтому транс-соединение дает только один продукт. [3]
В кислой среде происходит гидролиз цикло-ексаноноксима с образованием циклогексанона и выделением экви-алентного количества соли гидроксиламина. [4]
Таким образом, реакция протекает в четыре стадии: образование моноцианэтилированного циклогексанона ( I) ( возникновение первого асимметрического атома углерода), образование дицианэтилированного продукта ( II) ( асимметрический центр исчезает), затем образование грицианэтилированного циклогексанона ( III) ( появление нового центра асимметрии) и, наконец, образование тетрацианэтилированного циклогексанона ( IV) с полной симметризацией молекулы. Рацемизация ( I) и ( III) возможна, но при низких температурах ( 20 - 25) она невелика. [5]
Роль оксициклогексилгидроперекиси не ограничивается только ее участием в реакции образования циклогексанона. По-видимому, она является главным продуктом, ионный распад которого приводит к образованию оксикапроновой кислоты, а радикальный распад - к капроновой кислоте. Обе эти кислоты содержатся в продуктах окисления циклогексана, хотя и в небольших количествах. [6]
Этот результат однозначно показывает, что существует другой пуп, образования циклогексанона помимо распада гидроперекиси. [7]
Восстановление 2-циклогексенона и изофорона действием Bu4NBH4 в ТГФ протекает с образованием циклогексанонов и циклогексанолов ( 1 4-атака) с выходом 85 и 96 % соответственно. [8]
Точно так же можно осуществить циклизацию диэтилового эфира пимелиновой кислоты с образованием производного циклогексанона, но 2-карбэгоксициклогыгганон из диэтилового эфира пробковой кислоты получается с низким выходом. Интрамолекулярная циклизация сложных эфиров глутаровой, азслаиновой и себациновой кислот в присутствии этилата натрии не идет. [9]
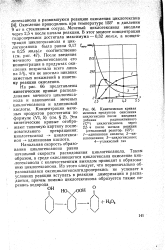 |
Кинетическая кривая меченых продуктов окисления циклогексана после введения добавки радиоактивного. [10] |
Таким образом, в среде окисляющегося циклогексана окисление циклогексанола с количественным выходом приводит к образованию циклогексанона. [11]
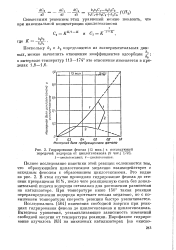 |
Гидрирование фенола ( 15 мин. с последующей. [12] |
Полное исследование кинетики этой реакции осложняется тем, что образующийся циклогексанол медленно взаимодействует с исходным фенолом с образованием циклогексанона. [13]
Равновесие смещается в зависимости от температуры: при более высоких температурах образуется преимущественно кето-форма, это гидрирование ведет к образованию циклогексанона; при более низких температурах равновесие смещается в сторону енольной формы, поэтому образуется главным образом циклогексанол. [14]
Это справедливо в том случае, если стадии, определяющие скорость, одинаковы как при гидрогенизации метилбензолов, так и при образовании циклогексанона в качестве ппомежуточного соединения при гидрогенизации фенола. Кроме того, расщепление не следует рассматривать как отдельную стадию, происходящую после гидрогенизации, так как метоксициклогексан не расщепляется в применяемых условиях. [15]
Страницы: 1 2 3