Образование - электролит
Cтраница 1
Образование электролитов может происходить различными путями: 1) диссоциацией растворенных полярных молекул под действием полярных молекул растворителя; 2) растворением ионных кристаллов с образованием гидратированных ионов; 3) плавлением ионных кристаллов. [1]
Образование электролитов может происходить различными путями: 1) диссоциацией растворенных полярных молекул под действием полярных молекул растворителя; 2) растворением ионных кристаллов с образованием гидратированных ионов; 3) плавлением ионных кристаллов. Последний путь образования электролитов также может сопровождаться процессами растворения. [2]
Возможность образования электролита зависит также от способности вещества поглощать и удерживать влагу. Как известно, ряд химических веществ, в частности широко распространенная в природе поваренная соль, захватывают влагу из атмосферы. Однако количества влаги, захваченного самими ионообразующими веществами, обычно недостаточно для их полного растворения. Поэтому / ля растворения ионообразующих веществ большое значение имеют находящиеся на поверхности нейтральные вещества ( не образующие ионов), которые поглощают и удерживают водяную пленку значительной толщины. [4]
Возможность образования электролита зависит также от способности вещества поглощать и удерживать влагу. Как известно, ряд химических веществ, в частности широко распространенная в природе поваренная соль, захватывают влагу из атмосферы. Однако количества влаги, захваченного самими ионообразующими веществами, обычно недостаточно для их полного растворения. Поэтому у ля растворения ионообразующих веществ большое значение имеют находящиеся на поверхности нейтральные вещества ( не образующие ионов), которые поглощают и удерживают водяную пленку значительной толщины. [6]
Последний путь образования электролитов также может сопровождаться процессами растворения. [7]
Обычно это влияние объясняется образованием электролита в результате химической конденсации влаги на поверхности металла. Последующее же развитие процессов рассматривается с позиций общей электрохимической теории коррозии. [8]
Для бесконечно разбавленных растворов энтальпия образования электролита тождественно равна сумме энтальпий образования ионов, на которые молекула этого электролита диссоциирует. [9]
Ионизация газов не приводит к образованию электролитов, так как основной проводящей электрический ток частицей будет электрон. [10]
Разница вызвана тем, что свободные энергии окислений, приводящих к образованию электролитов, часто значительно менее отрицательны, чем соответствующие общие энергии. [11]
Имеются растворители с низкой диэлектрической проницаемостью, способные взаимодействовать с солями с образованием электролитов, имеющих достаточно высокую электрическую проводимость. Например, тетра-гидрофуран может поглощать газообразный BF3 с образованием комплекса и растворять фтористый литий с образованием электролита. [12]
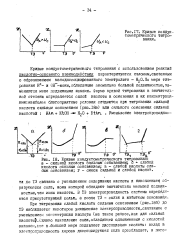 |
Кривые кондуктометрического титрования. а - сильной кислоты сильным основанием. б - слабой кислоты сильным основанием. в - слабой кислоты слабым основанием. г - смеси сильной и слабой кислот. [13] |
Кривые кондуктометрического титрования с использованием реакций кислотно-основного взаимодействия характеризуются изломом связанным о образованием малодиссоциированного электролита - f O. IIo мере титрования Н - и ОН - - ионы обладающие аномально большой подвижностью заменяются мене подвижными ионами. Форма кривой титрования в значительной степени определяется силой кислоты и основания и их концентрациями: наиболее благоприятные условия создаются при титровании сильной кислоты сильным основанием ( рис. 18а) шш сильного основания СИЛЬНОЕ кислотой: НАИ. [14]
Любая реакция нейтрализации сводится к взаимодействию ионов ОН - и Н с образованием малодиссоциированного электролита - воды. [15]
Страницы: 1 2 3