Обратимость - реакция
Cтраница 1
Обратимость реакций ( VI, 46) и ( VI, 47) может быть легко проверена, если сравнить разность потенциалов между двумя данными точками экспериментально полученной волны со значением разности потенциалов, вычисленных из уравнений волны. [1]
Обратимость реакции обнаруживается также в тенденции первоначально образовавшихся продуктов превращаться в стабильные изомеры при более высокой температуре. [2]
Обратимость реакций, ведущих к образованию симметричного ад-дукта, должна приводить к переносу метки О18 к растворителю. В этих опытах, проводившихся как в кислой, так и в щелочной среде, метка О18 появляется в растворителе до проведения гидролиза или омыления сложного эфира. Это может происходить только в том случае, если молекула воды или ион гидроксила присоединяются к карбонильной группе. [3]
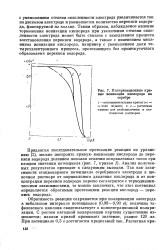 |
Поляризационные кривые ионизации кислорода на серебре. [4] |
Обратимость реакции сохраняется при поляризации электрода в небольшом интервале потенциалов ( 0 98 - 0 90 в); величина та-фелевского наклона свидетельствует о концентрационной поляризации. С ростом катодной поляризации картина существенно изменяется; наклон кривой принимает значение, равное 120 мв. При потенциале 0 3 в достигается предельный ток. [5]
Обратимость реакции требует строгого соблюдения определенных условий при титровании. [6]
Обратимость реакции существенно сказывается на результатах реакции. [7]
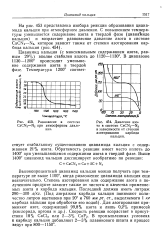 |
Давление азота в системе CaCN2 - N2 в зависимости от степени азотирования карбида кальция. [8] |
Обратимость реакции имеет место вплоть до 1400 при уменьшающемся содержании азота в твердой фазе. [9]
Обратимость реакции из-за гидролиза образующейся соли, растворения осадка или диссоциации комплексов приводит к появлению округлений вблизи к. Вследствие этого повышаются ошибки титрования. Вследствие увеличения концентрации титранта в 25 - 50 раз по сравнению с концентрацией определяемого раствора уменьшается разбавление, а в связи с этим уменьшается искажение кондуктограммы. Кондуктометрическое титрование требует больше времени, чем титрование с цветными индикаторами, поэтому применяют его тогда, когда индикаторное титрование невозможно: 1) при определении концентрации очень слабых кислот и оснований; 2) при анализе окрашенных растворов или растворов с осадком; 3) при анализе многокомпонентных систем. [10]
Обратимость реакции может быть установлена различными способами. [11]
Обратимость реакции обнаруживается также в тенденции первоначально образовавшихся продуктов превращаться в стабильные изомеры при более высокой температуре. [12]
Обратимость реакции АТР-синтазы имеет чрезвычайно важное значение для клетки. Например, образовавшийся в результате субстратного фосфорилирования АТР может быть использован АТР-синтазой для создания протонного градиента. Таким образом, этот фермент может также играть роль протонного насоса. Благодаря обратимости процессов, протекающих при этом в плазматической мембране, протонный градиент и АТР могут как бы взаимно превращаться друг в друга. [13]
Обратимость реакции алкилирования решающим образом сказывается на изомерном составе, продуктов. В присутствии катализатора, например AlCls HCl, о - и я-диалкилбензолы перегруппировываются в жега-изомерьь Изомеризация ксилолов ( см. разд. [14]
Обратимость реакции диссоциации выражают в уравнениях двумя противоположными стрелками, заменяющими знак равенства. [15]
Страницы: 1 2 3 4