Обратимость - стадия
Cтраница 2
Исходит изомеризация чистых цис - или тргшс-олефинов под действием малых количеств тиола; этот факт использовали в качестве доказательства обратимости стадии присоеди нения. Например, цис - или тринс-бутен-2 образует равновесную смесь под действием малых количеств метантиола 1801; это показывает, что тииловыи радикал присоединяется к олефину с образованием промежуточного радикала, ия которого получается равноиесная смесь, а латем происходит диссоциаций на тииловыи радикал и смесь цис - и тршьс - - олефинов. При 60Э обратные реакции протекают в 20 и 85 раз быстрее, чем стадия переноса. [16]
Таким образом, исследование соотношения орто - и пара-водорода в электролитическом газе при низких температурах позволяет получить сведения о степени обратимости стадии удаления адсорбированного водорода. [17]
В случае стабильных илидов механизмы ( а) и ( б), очевидно, невозможны, поскольку Специале и Биссинг [49] доказали обратимость стадии образования бетаина. [18]
Если бы самой медленной была стадия ( 18), то должны были бы образовываться заметные количества альдегида и енолята, находящихся в равновесии вследствие обратимости стадии. В действительности этого не наблюдается. [19]
Авторы переносят вывод о перегруппировке кислородной функции в бензпинаколине на изомерные превращения других кетонов, а также и на пинаколиновые перегруппировки и, таким образом, утверждают обратимость стадии образования ке-тона в пинаколиновых перегруппировках. [20]
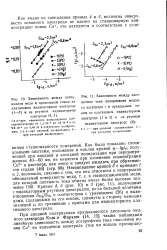
Как было показано специальными опытами, положение и наклон кривой ф - Igt d, полученной при анодной и катодной поляризации при перенапряжениях 40 - 60 мв, не меняется при изменении концентрации Си2 в растворе, как этого и следует ожидать при обратимости стадии ( 46) ( стр. Кривые 4, 5 ( рис. 10) и 3 ( рис. 11), полученные с индикаторным ртутным электродом, из-за большей величины отношения SHg / Scu в соответствии с уравнением ( 26) и выводами, сделанными на: его основе, сдвинуты в сторону меньших значений id по сравнению с кривыми для индикаторного платинового электрода. [22]
Выяснена обратимость стадии взаимодействия этилена с адсорбированным кислородом и вычислен ряд констант в кинетических уравнениях. [23]
Как мы видели при рассмотрении реакций свободнорадикального замещения, стадия переноса атома в некоторых случаях является обратимой, что затрудняет трактовку кинетических данных и предсказание реакционной способности различных субстратов. В случае реакций присоединения возможность обратимости стадии а) четко доказана на ряде примеров. Так, известно, что при свободнорадикальном присоединении бромистого водорода к сте-реоизомерным олефинам при комнатной температуре происходит изомеризация исходных олефинов, что свидетельствует об обратимости присоединения атома брома. Такая картина типична для двухстадийных процессов с обратимой первой стадией. Так как стадия присоединения атома брома является экзотер-мичной, при увеличении температуры происходит сдвиг равновесия влево, что и приводит к уменьшению суммарной скорости процесса. [24]
Как мы видели при рассмотрении реакций свобсднорадикаль-ного замещения, стадия переноса атома в некоторых случаях является обратимой, что затрудняет трактовку кинетических данных и предсказание реакционной способности различных субстратов. В случае реакций присоединения возможность обратимости стадии а) четко доказана на ряде примеров. [25]
Поскольку уравнение ( 5.10 а) пригодно как для катодных, так и для анодных поляризаций, потенциал полуволны в обоих случаях будет одним и тем же. Этот критерий часто используют, чтобы установить степень обратимости стадии разряда-ионизации. [26]
Эта реакции широко пс изучена. Не были проведены стереохи-мнческие исследования, отсутствуют данные об обратимости стадии присоединения, четко не определены границы применения реакции. В бштьшипстнс описанных примеров инициатором служил кислород или специально прибавляемый или присутствовавший случайно. [27]
Эта реакция широко не изучена. Не были проведены стереохи-мические исследования, отсутствуют данные об обратимости стадии присоединения, четко не определены границы применения реакции. В большинстве описанных примеров инициатором служил кислород или специально прибавляемый или присутствовавший случайно. [28]
Это делают следующим образом. Если имеется йнтермедиат R, то введение лиганда X должно понижать скорость реакции, так как в результате обратимости стадии диссоциации понижается концентрация интермедиата. Второй подход основан на увеличении скорости реакции г зависимости от инертного электролита. [29]
Поскольку нейтральные амины не являются металлирующи-ми агентами, вероятнее всего, димеризация ( 63) идет по анион-радикальному механизму. Образование продуктов замещения ( 64) в присутствии кислорода и димеризация ( 65) в инертной среде свидетельствуют об обратимости стадии образования сг-комплекса и анион-радикала. [30]
Страницы: 1 2 3