Бикарбонат-ион
Cтраница 1
Бикарбонат-ион НС03 - будет реагировать с водой по уравнению, указанному выше, но в присутствии углекислой соды бикарбонат действует как кислота, стремясь обратить реакции, которые протекают при гидролизе углекислой соды в водном растворе. Сесквикарбонат натрия ( Na2CO3 - NaHCO3 - 2H2O) в водном растворе легко распадается на карбонат и бикарбонат натрия. [1]
Концентрация бикарбонат-ионов, образующихся по последнему уравнению, постепенно увеличивается. С увеличением концентрации часть ионов переходит из эритроцитов в плазму крови. Это вызывает в свою очередь переход хлор-ионов из плазмы в эритроциты, что необходимо для сохранения электронейтральности внутри клеток. Процесс перехода хлор-ионов называют хлоридным сдвигом. [2]
В присутствии бикарбонат-ионов этот аддукт быстро расщепляется на диэтило-вый эфир малоновой кислоты и бензилиденглицинат-анион. [3]
 |
Основные этапы процесса свертывания крови. [4] |
Большая часть бикарбонат-ионов, образующихся в эритроцитах, диффундируют оттуда по градиенту концентрации в плазму, где вместе с присутствующими там натрий-ионами дают раствор бикарбоната натрия. Утрата эритроцитами отрицательно заряженного бикарбоната создает в них положительный заряд, который компенсируется поступающими из плазмы хлорид-ионами. Это явление называют хлоридным сдвигом, или сдвигом Хамбургера. [5]
В присутствии бикарбонат-ионов этот аддукт быстро расщепляется на диэтило-вый эфир малоновой кислоты и бензилиденглицинат-анион. [6]
Так как активность бикарбонат-иона находится в обратной зависимости от рН, в этом выражении должна быть отражена зависимость кажущейся константы от четвертой степени концентрации ионов водорода, при которой исследовалось равновесие, и прямая зависимость от парциального давления двуокиси углерода в атмосфере, в равновесии с которой они находятся. Из величин, которые используются для количественного описания связывания металлов с трансферрином, по-видимому, наиболее важны с точки зрения физиологии кажущиеся константы устойчивости. [7]
Так как при этом бикарбонат-ион переходит в карбонат СО32 -, создается щелочная среда и Mg2 осаждается в форме основного карбоната. Этот процесс осуществляется при кипячении речной или водопроводной воды. [8]
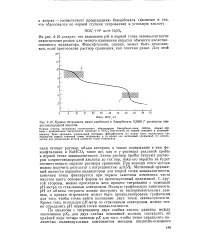 |
Кривая титрования смеси карбоната и бикарбоната 0 3500 F раствором хлористоводородной кислоты. [9] |
Первая ступень титрования соответствует образованию бикарбонат-иона ( НСОз), вторая ступень-превращению бикарбоната ( включая и НСО3 полученный по первой ступени) в угольную кислоту. Если следовать специальной методике, фенолфталеин ( 2) может быть использован как индикатор первой конечной точки титрования, в то время как метиловый оранжевый ( 1) используется для определения второй конечной точки титрования. [10]
В постоянно жесткой воде относительное содержание бикарбонат-иона недостаточно, чтобы связать все положительные ионы жесткой воды, поэтому такую воду нельзя смягчить кипячением. Обычно для смягчения воды используют стиральную соду и нашатырный спирт, которые осаждают положительные ионы тяжелой воды. [11]
Общую щелочность, или щелочность от бикарбонат-ионов НСОГ ( гидрокарбонат-ионов), определяют в водных вытяжках всех почв. [12]
Мы видим, что вместе с устойчивыми бикарбонат-ионами НСОз появляются ионы ОН, которые обычно присутствуют в растворах гидроокисей. Можно считать, что растворы оснований скользкие на ощупь и имеют горький вкус благодаря присутствию гидроксильных ионов. Исчезновение кислотных свойств растворов [ реакция ( 25) ] объясняется устойчивостью бикарбонат-ионов. [13]
Позже Линен показал, что 4С - бикарбонат-ион является лучшим субстратом, чем свободный 14С02, так как включается в продукт гораздо быстрее. [14]
Какие соединения, кроме угольной кислоты и бикарбонат-иона, уносят двуокись углерода из тканей. [15]
Страницы: 1 2 3 4