Окисел - алюминий
Cтраница 2
При сварке алюминиевых бронз основное затруднение вызывается образованием в ванне тугоплавкого окисла алюминия. Поэтому для сварки бронз с содержанием А1 9 % следует применять флюс состава: 12 - 16 % фтористого натрия, 20 % хлористого натрия, 20 % хлористого бария, остальное - хлористый калий. Для лучшего удаления окиси алюминия из сварочной ванны жидкий металл следует перемешивать присадкой, которая по составу должна примерно соответствовать основному металлу. [16]
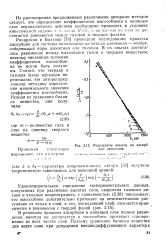 |
Результаты опытов по адсорбции изооктана. [17] |
Ричардсон и Бахтиар [33] проводили исследование процесса адсорбции для системы катализатор из окисла алюминия - воздух, содержащий пары изооктана или толуола. [18]
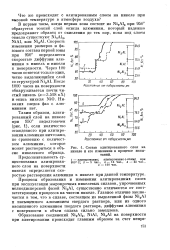 |
Состав алитированного слоя на никеле и его изменение в процессе испытаний. [19] |
В первые часы, когда первая зона состоит из Ni2Al3 при 950 образуется тонкий слой окисла алюминия, который надежно предохраняет образец от окисления до тех пор, пока под слоем окисла существуют Ni2Al3, NiAl, или NisAl. Скорость изменения размеров и фазового состава первой зоны при 950 определяется скоростью диффузии алюминия в никель и никеля к поверхности. [20]
Например, глубокое анодирование алюминия при температуре 286 - 300 К позволяет получать защитную пленку из окисла алюминия толщиной 10 - 15 мкм. Увеличение времени пребывания металла в ванне приводит к уравновешиванию процессов растворения и окисления. [21]
Наибольшее применение в качестве восстановителя получил алюминий-малолетучий и сравнительно недорогой металл; кроме того, реакция образования окисла алюминия сильно экзотер-мична. Это дает возможность проводить реакции восстановления многих металлов алюминием без дополнительного нагревания реакционной смеси. [22]
Методы ХОП получили широкое распространение для нанесения покрытий на основе карбидов, нитридов, карбонитридов титана, а также окисла алюминия на многогранные неперетачиваемые твердосплавные пластинки. [23]
То обстоятельство, что алюминиЕ не реагирует с водой и с разбавленными, слабо диссоциирующими кислотами, объясняется образованием чрезвычайно трудно растворимого окисла алюминия, произведение растворимости которого в растворах с низкой концентрацией водородных ионов еще не достигается. Напротив, в щелочах окись алюминия растворима с образованием гидроксоалюминатов ( см. стр. [24]
То обстоятельство, что алюминий не реагирует с водой и с разбавленными, слабо диссоциирующими кислотами, объясняется образованием чрезвычайно трудно растворимого окисла алюминия, произведение растворимости которого в растворах с низкой концентрацией водородных ионов еще не достигается. Напротив, в щелочах окись алюминия растворима с образованием гидроксоалюминатов ( см. стр. [25]
По закону Гесса прохождение реакции термодинамически обеспечено слева направо, так как сумма теплот образования окислов в левой части уравнения значительно меньше теплоты образования окисла алюминия в правой части, даже без учета тепла, которое идет на образование германида. [26]
Низкая удельная плотность ( 2 7 г / см3) и температура плавления ( 660 С) алюминия по сравнению с высокой удельной плотностью окисла алюминия А12О3 ( 3 85 г / см3) и его температурой плавления ( 2050 С) затрудняют процесс сварки. Тугоплавкий и тяжелый окисел А12О3 может оставаться в металле шва и снижать работоспособность сварного соединения. [27]
Если оксидную пленку дополнительно обработать в горячей воде или растворах хроматов ( процесс наполнения пленки), то ее защитные свойства заметно возрастают в результате образования в порах гидратированного окисла алюминия, имеющего больший объем, чем АЬОз, так как этот гидратированный окисел закрывает поры в пленке. [28]
Для очистки водорода от следов кислорода и влаги иногда применяют осушители с платинированным асбестом или активированной окисью алюминия, обеспечивающие точку росы газовой смеси - 60 С, а также палладиевые катализаторы с последующим прохождением газа через столб активированного окисла алюминия, поглощающего оставшиеся следы влаги. Последний способ обеспечивает точку росы газовой смеси - 80 - 100 С. [29]
Бор является отчетливо выраженным кислотообразующим элементом. Окисел алюминия по отношению к сильным основаниям может еще проявлять свойства кислотного окисла, однако в обычных условиях он ведет себя как основной окисел. Окислы галлия ( III) и индия ( III) также обладают амфотерными свойствами с преимущественно основным характером. Амфотерный характер окисла таллия ( III) вследствие его исключительно низкой растворимости проявляется в меньшей степени. Напротив, окисел таллия ( I) имеет сильно основной характер. Получающаяся из него гидроокись похожа в этом отношении на гидроокиси щелочных металлов. [30]
Страницы: 1 2 3 4