Амфотерный окисел
Cтраница 1
Амфотерный окисел Сг2Оз характеризуется реакциями солеобразования и с кислотами, и с основаниями. [1]
Амфотерный окисел Сг2О3 характеризуется реакциями солеобразования и с кислотами, и с основаниями. [2]
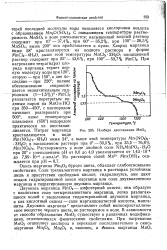 |
Изобара диссоциации МпО2. [3] |
Двуокись марганца МпО2 - амфотерный окисел; она образует с кислотами соли четырехвалентного марганца, легко разлагающиеся водой с выделением гидратированной двуокиси марганца, а как кислотный окисел - соли марганцоватистой кислоты, манга-йиты. Двуокись марганца7 представляет собой мелкокристаллическое вещество черного цвета, не растворимое в воде. В зависимости от способа образования МпО2 существует в различных модификациях, отличающихся физическими свойствами. [4]
Окись алюминия А12О3 - амфотерный окисел, как правило, повышает температуру размягчения и вязкость фритты, снижает коэффициент теплового расширения стекол и покрытий. Окись алюминия вводят в стекла и фритты, добавляя в шихту глинозем, каолин, полевой шпат. [5]
Двуокись марганца МпОз - амфотерный окисел, но оба типа солей, образуемых им - нормальные соли ( MnCU) и манганиты ( Ыа2МпОз) - очень неустойчивы. [6]
Двуокись германия GeO2 - амфотерный окисел, представляет собой белый порошок, растворимый в кислотах с образованием соответствующих солей. В воде заметно растворяется, образуя германиевую кислоту Ge ( OH) 4; эта кислота в чистом виде не выделена, но соли ее - германаты - известны. [7]
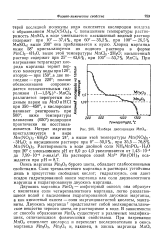 |
Изобара диссоциации МпОа. [8] |
Двуокись марганца Мп02 - амфотерный окисел; она образует с кислотами соли четырехвалентного марганца, легко разлагающиеся водой с выделением гидратированной двуокиси марганца, а как кислотный окисел - соли марганцоватистой кислоты, манга-ниты. Двуокись марганца 7 представляет собой мелкокристаллическое вещество черного цвета, не растворимое в воде. В зависимости от способа образования Мп02 существует в различных модификациях, отличающихся физическими свойствами. [9]
Двуокись титана Ti02 - амфотерный окисел с преобладанием основных свойств. Так, гидроокись титана Ti ( OH) 4 растворяется в кислотах, но почти не растворяется в щелочах. [10]
Двуокись марганца Мп02 - амфотерный окисел, часто неправильно называемый перекисью марганца. Применяется, как уже было указано, в качестве катализатора при получении кислорода из бертолетовой соли и при разложении перекиси водорода. В сухих элементах служит деполяризатором. Как окислитель двуокись марганца применяют, например, при получении хлора из соляной кислоты в лабораторных условиях. [11]
Так как алюминий и его амфотерный окисел А12О3 растворяются как в щелочах, так и в кислотах, то травление алюминиевых изделий производится в щелочных или в кислых растворах, чаще всего в первых, так как туда идет и растворение пленки окисла, покрывающего металл. Травление ведется в 10 - 20 % - ном растворе едкого натра при 50 - 80 С в продолжение 2 - 3 мин. Лучшего вида поверхность получается при более сложных травильных растворах, как, например, током: 100 г едкого натра, 20 г поваренной соли, 1 л воды. Для получения блестящей поверхности предложен следующий раствор: 50 - 100 г едкого натра, 20 - 50 г фтористого натрия, 1 л воды. При большом содержании меди в алюминии в травильные растворы добавляют азотную кислоту, а при кремнии, никеле и других присадках к алюминию добавляют в редких случаях плавиковую кислоту; плавиковая кислота удаляет также темные пленки на алюминии. [12]
Двуокись марганца Мп О2 - амфотерный окисел; она образует с кислотами соли четырехвалентного марганца, легко разлагающиеся водой с выделением гидратированной двуокиси марганца, а как кислотный окисел - соли марганцоватистой кислоты, манганиты. Двуокись марганца3 представляет собой мелкокристаллическое вещество черного цвета, нерастворимое в воде. В зависимости от способа образования МпО2 существует в различных модификациях, отличающихся физическими свойствами. [13]
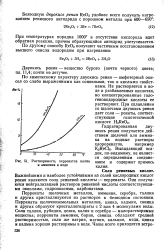 |
Растворимость перренатов калия и аммония в воде. [14] |
По химическому характеру двуокись рения - амфотерный окисел со слабо выраженными как основными, так и кислыми свойствами. Не растворяется в воде и разбавленных кислотах, но концентрированные гало-геноводородные кислоты ее растворяют. [15]
Страницы: 1 2 3