Амфотерный окисел
Cтраница 3
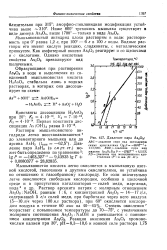
Устойчивая ниже 570 кубическая модификация - бесцветные кристаллы. Амфотерный окисел взаимодействует с кислотами и щелочами. Туман, образуемый парами SbjOg, и ее взвешенная пыль устойчиво держатся в воздухе. [31]
Мышьяковистый ангидрид плохо растворим в воде: растворимость при 0 равна 1 2 г, при 100 - 6 г в 100 г воды. Водные растворы его имеют кислую реакцию, сладковаты, с металлическим привкусом. Как амфотерный окисел А 2О3 реагирует и со щелочами и с кислотами. [33]
Мышьяковистый ангидрид плохо растворим в воде: растворимость при 0 равна 1 2 г, при 100 - 6 г в 100 г воды. Водные растворы его имеют кислую реакцию, сладковаты, с металлическим привкусом. Как амфотерный окисел А 203 реагирует и со щелочами и с кислотами. Однако кислотные свойства As2O3 превалируют над щелочными. [34]
Некоторые элементы, проявляющие переменную валентность, в низших ступенях окисления образуют основные окислы, а в высших - ангидриды кислот. К таким элементам относится, например, марганец, образующий ряд окислов. В средней же степени окисления ( Мп02) марганец образует амфотерный окисел. [35]
Сильное взаимодействие ионов М2 с водой проявляется также в повышенной склонности к гидролизу по сравнению с ионами М4 элементов I группы. В табл. 45 приведены константы гидролиза ( Дгидр [ МОН ] [ Н ] / [ М2 ] для этих элементов. Во всяком случае, ион Ве2 несомненно является значительно более кислым, чем ионы остальных элементов этой группы, и только этот ион образует амфотерный окисел. [36]
Черный поро - шок, не растворяется в HNOs, H2SO4 и НС1, при температуре 700 С разлагается. Сг з образуется при горении хрома в кислороде. Сильно прокаленная окись не растворяется в воде, кислотах и растворах щелочей. В обычных условиях - амфотерный окисел, растворимый, в кислотах и растворах щелочей. [37]
В двухвалентном состоянии марганец напоминает магний. Его гидрат окисла очень мало растворим в воде, но обладает, как и Mg ( OH) 2, ясно выраженными основными свойствами. Соли двухвалентного марганца, как правило, изоморфны с солями магния. Соли магния и двухвалентного марганца, производимые от одних и тех же кислот, сходны также по растворимости. Двуокись марганца МпО2 - амфотерный окисел; но оба типа солей, образуемых им, - нормальные соли ( МпС14) и мангаяиты ( Na2MnO3) очень неустойчивы. [38]
Страницы: 1 2 3