Окисление - пирит
Cтраница 4
Экстракция производится примерно 16 - 18 часов. При перерыве в экстракции необходимо следить, чтобы фильтр с осадком в патроне оставался покрытым ацетоном для уменьшения возможности окисления пирита или марказита. [46]
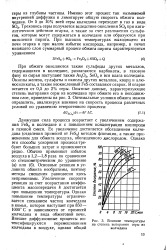 |
Влияние температуры. [47] |
Именно этот процесс так называемой внутренней диффузии и лимитирует общую скорость обжига колчедана. Трехокись серы получается вследствие окисления SO2 при каталитическом действии огарка, а также за счет разложения сульфатов, которые могут содержаться в колчедане или образуются при окислении пирита. [48]
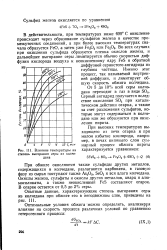 |
Влияние температуры на степень выгорания серы из колчедана. [49] |
Именно этот процесс, так называемой внутренней диффузии, и лимитирует общую скорость обжига колчедана. Серный ангидрид получается вследствие окисления SOa при каталитическом действии огарка, а также за счет разложения сульфатов, которые могут содержаться в колчедане или же образуются при окислении пирита. [50]
Трусов [3] описал метод прямого определения сульфидного железа в породах, содержащих пирит, где используется устойчивость пирита действию плавиковой и серной кислот. Любой остаток закисного или окисного железа, а это возможно, если в породе содержатся такие минералы, как хромит и магнетит, будет принят за сульфидное железо и даст положительную ошибку, которую, правда, можно в некоторой степени компенсировать отрицательной ошибкой, вызванной окислением пирита. Описание этого метода приведено ниже. Он неприменим к породам, содержащим минерал пирротин, который растворим в используемом кислом растворе. [51]
При образовании соответствующих оксидов в диапазоне температур 400 - 500 С происходит разложение карбоната железа, а в диапазоне температур 600 - 1000 С - разложение карбонатов кальция и магния. Кварц претерпевает полиморфное превращение при 573 С. Окисление пирита происходит при температуре 400 - 700 С с образованием оксидов железа и серы. В полувосстановительной среде гематит переходит в магнетит, FeO может восстанавливаться в железо или соединяться с кремнеземом в легкоплавкие силикаты. В зоне высоких температур ( 1200 С) появляются эвтектические смеси, которые составляют стекловидную фазу. В результате превращений минеральной части топлива образуются вещества с новыми свойствами - зола и шлак. При факельном сжигании углей большая часть минерального вещества топлива переходит в золу и меньшая часть - в шлак. [52]
Практически установлено, что оптимальная температура обжига пиритных концентратов зависит от их вещественного состава и колеблется в пределах 500 - 700 С. Расчеты и экспериментальные исследования показывают, что вследствие перегрева огарка температура его может превышать температуру в печи на 300 - 400 С. Взаимосвязь между скоростью окисления пирита и температурой его зерен указывает на то, что для получения пористого огарка скорость окислительных реакций необходимо регулировать таким образом, чтобы температура частиц при обжиге не превышала 900 - 950 С. [53]
С, варьирует от 13 53 до 27 23 Дж на 1 см3 прореагировавшего кислорода, а для каменных углей эта величина колеблется от 12 82 до 18 56 Дж / см3 Og. Причиной выделения тепла может быть окисление пирита, который часто содержится в угле. Расчеты, проведенные Крымом, показывают, что при окислении 1 % пиритной серы выделяется такое количество тепла, которое может повысить температуру тонны угля до 117 С, а по мнению Агроскина - до 251 С. [54]
Вторично он был обнаружен в 1901 г. 2 при исследовании действия солей железа ( III) на пирит и другие сульфиды. Несколько ранее3 было найдено, что при этом происходит окисление пирита и восстановление железа ( III), но тогда еще не было замечено, что это взаимодействие идет очень легко и что пирит окисляется полностью: не только содержащееся в нем железо, но и большая часть серы. Сам по себе чистый пирит при кипячении с разбавленной серной или плавиковой кислотой или смесью обеих разлагается крайне медленно, но как только прибавляют какую-нибудь соль железа ( III), картина резко меняется. [55]
Ключ к решению вопроса был найден х в 1882 г., но эта работа осталась неизвестной химикам. Вторично он был обнаружен в 1901 г. 2 при исследовании действия солей железа ( III) на пирит и другие сульфиды. Несколько ранее 3 было найдено, что при этом происходит окисление пирита и восстановление железа ( III), но тогда еще не было замечено, что это взаимодействие идет очень легко и что пирит окисляется полностью: не только содержащееся в нем железо, но и большая часть серы. Сам по себе чистый пирит при кипячении с разбавленной серной или фтористоводородной кислотой или смесью обеих разлагается крайне медленно, но как только прибавляют какую-нибудь соль железа ( III), картина резко меняется. [56]
Из изложенного выше следует, что загрязнение подземных вод в основном происходит в III зоне. Во II зоне оно наблюдается в результате подтягивания более минерализованных вод нижележащих горизонтов в процессе эксплуатации дренажа и поступления продуктов метаморфи-зации осушенных пород. Из большого числа загрязняющих компонентов приоритетное значение здесь имеют продукты окисления пирита и сульфидных минералов тяжелых металлов, содержащихся в углях и пустых породах; сернокислотного выщелачивания алюмосиликатов и карбонатов пустых пород. Указанные процессы имеют место и в отвалах пустых пород. Окисление перечисленных минералов, как правило, усиливается с увеличением размеров зоны аэрации и площади отвалов пустых пород на поверхности. [57]
Из всего сказанного не следует делать вывод, что лимониты ( см. ниже) не могут давать ценных пигментов. С полной очевидностью установлено обратное, но эти пигменты не являются охрами. Лимонит образовался из пирита, являющегося сернистым железом; при окислении пирита образуется гематит ( не глинистая окись), а потому для образования лимонита должно произойти смешение пирита с глиной. [58]
Из полученных соотношений видно, что с усилением окислительных режимов разница в скоростях окисления минералов растет. Из соотношения ( 13) следует, что при смещении потенциала на 50 мВ скорость окисления арсенопирита превышает скорость окисления пирита в 1 98 раза, на 100 мВ - в 2 62 раза. Из соотношения ( 14) следует, что при производительности электролизера по кислороду 25 мг / мин скорость окисления арсенопирита будет в 1 4 раза выше скорости окисления пирита, при производительности 50 мг / мин - в 1 5 раза. [59]
Страницы: 1 2 3 4