Окисление - тиоэфир
Cтраница 1
Окисление тиоэфиров должно идти в более мягких условиях по сравнению с другими органическими соединениями, так как, являясь сильными донорами электронов, тиоэфиры легко активируются на поверхности катализатора. [1]
Окисление тиоэфиров на СиО идет с образованием сульфоксидов. Скорость окисления при r1000C и повышенном давлении без растворителя очень мала, но существенно повышается в присутствии кислотного растворителя. Оксидаты окрашены в желто-зеленый цвет. Добавка карбо-новой кислоты к окисляющемуся без растворителя дибутилсульфиду увеличивает скорость реакции. Еще большее повышение скорости достигается при введении в систему сульфоксида, при этом с самого начала увеличивается содержание ионов Си2 в растворе. Окисление тиоэфиров происходит также под [ влиянием растворимых соединений меди. Поэтому можно считать, что так же, как и на окислах ванадия, реакция окисления тиоэфиров в присутствии окисла меди ускоряется в основном ионами меди, появляющимися в растворе вследствие взаимодействия СиО с некоторыми продуктами реакции. [3]
Возможно гомогенно-каталитическое окисление тиоэфиров кислородом при использовании в качестве катализатора щелочных добавок [751]; реакция идет по радикальному механизму, вследствие чегс получается сложная смесь продуктов, не содержащая сульфоксидов или сульфонов. [4]
При окислении тиоэфиров окислами азота или азотной кислотой в реакционную смесь иногда вводят дополнительно сокатализаторы. [5]
При окислении несимметричных тиоэфиров получаются только несимметричные сульфоксиды и сульфон, сохраняющие скелет исходно-то тиоэфира, что подтверждает вывод об образовании этих соединений непосредственно из тиоэфира, а не из продуктов его деструкции. [6]
При окислении нефтяных тиоэфиров получаются важные вещества - сульфоксиды и сульфоны. [7]
Радикальный процесс окисления тиоэфиров может развиться также в результате дальнейшего превращения RS и R радикалов, образовавшихся при диссоциативной адсорбции. [8]
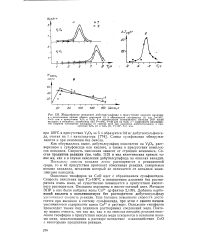
 |
Влияние времени контакта на количество адсорбированного диметилсульфида на V2O5 при 90 С. [9] |
Зависимость скорости окисления тиоэфиров от донорной способности атома серы существует, если медленным этапом является взаимодействие тиоэфира с кислородом. [10]
 |
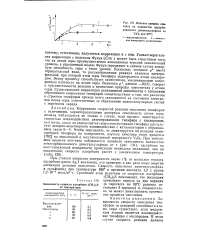
Зависимость логарифма скорости общего окисления тиоэфиров ( / и образования сульфоксидов ( / / в присутствии аце-тилацетоната ванадила от индуктивных постоянных уравнения Тафта. [11] |
Опыты по окислению тиоэфиров различного строения показывают, что скорость реакции уменьшается при замене алифатического радикала ароматическим. Теоретическое рассмотрение, сделанное В. И. Авдеевым, показывает, что при взаимодействии ванадила с тиоэфиром возможно достаточно эффективное перекрывание d - орбитали металла с Зр-орбиталыо серы, на которой находится неопределенная пара электронов. Совокупность полученных данных подтверждает, что реакция окисления тиоэфиров в присутствии комплексов ванадила, по-видимому, идет по радикально-цепному механизму. Инициирование заключается в донорно-акцепторном взаимодействии иона ванадила с неподеленной парой электронов атома серы тиоэфира, что приводит к гемолитическому распаду исходного соединения по С-S связи с образованием алкильного и тиильного радикалов. Развитие цепи происходит за счет перекисных радикалов, а обрыв - вследствие рекомбинации радикалов. [12]
К недостаткам процессов окисления тиоэфиров с использованием окислов азота относятся технологически сложное оформление процесса, особенно стадии регенерации катализатора; взрывоопасность, связанная со способностью окислов азота давать продукты присоединения к тиоэфиру, сульфоксиду; токсичность окислов азота и трудность очистки сульфоксида от загрязнения побочными продуктами и окислами азота. [13]
Корреляция скоростей реакции окисления тиоэфиров с величинами, характеризующими донорную способность атома серы, должна наблюдаться не только в случае, если процесс лимитируется скоростью взаимодействия активированного тиоэфира с кислородом, но и тогда, когда он определяется скоростью активации тиоэфира в результате донорно-акцепторного взаимодействия с катализатором с образованием связи S-V. [14]
В качестве катализатора реакций окисления тиоэфиров можно в принципе использовать металлы, окислы и сульфиды металлов. По аналогии с другими окислительными процессами можно предположить, что наиболее пригодны для этих целей окислы металлов. Под влиянием хемосорбированного тиоэфира и особенно продуктов его распада может измениться химический состав катализатора, например окисел металла может превратиться в сульфид или сульфат. Несмотря на это, последние, по-видимому, будут активировать молекулу тиоэфира, поскольку процесс связан с акцепторной способностью катиона ( см. гл. Поэтому изменение химического состава катализатора может не отразиться на его способности ускорять реакцию глубокого окисления; даже если на поверхности не будет необходимых для процесса активных форм кислорода, по-видимому, возможно взаимодействие продуктов деструкции тиоэфира с молекулярным кислородом. Осернение окисла должно явиться причиной снижения активности в отношении парциального окисления, для которого, вероятно, необходима не только активация тиоэфира, но и наличие на поверхности определенных форм активированного кислорода. [15]
Страницы: 1 2 3 4