Окисление - ферроцен
Cтраница 2
В работе [47] с помощью переменнотоковой вольтамперометрии ( кривые dE / dt - Е) было установлено, что окисление ферроцена и его производных на ртутном и платиновом анодах действи-тельно протекает обратимо. Потенциал, соответствующий точке перегиба на кривой окисления ферроцена, зависит от природы заместителя. [16]
Однако некоторые химические свойства ферроцена резко отличают его от ароматических соединений. Неспособность ферроцена к реакциям нитрования и галогенирования объясняется окислением ферроцена нитрующими и галогенирующими агентами в феррициний-катион, инертный к реакциям электрофильного замещения. [17]
Ранее [1] мы описали применение открытой нами реакции цианирования ферроцена действием жидкой синильной кислоты в тетрагидрофуране в присутствии хлорного железа для цианирования метил -, этил -, хлорфер-роцена и нитрила ферроценкарбоновой кислоты. В реакцию вступает катион феррициния ( или замещенного фсрргщшгая), образующийся при окислении ферроцена ( или его производных) хлорным железом. Мы показали на примере феррихлорида феррициния, что с заранее приготовленной солью феррициния выход нитрила получается ниже, чем при использовании смеси ферроцена и хлорного железа. [18]
До появления работ по фотолизу производных ферроцена был известе. Поздно предполагалось, что первой стадией такой реакции является перепое соль-ватированного электрона [ 51 на ферроцен с образованием [ C5H5FeC5lI5J - который вследствие своей неустойчивости распадается, вырывая протон ш молекулы растворителя, на циклопентадиен и металлическое железо. Следует отметить, что окисление ферроцена, напротив, приводит к образовании стабильного феррицшшй-катиона. [19]
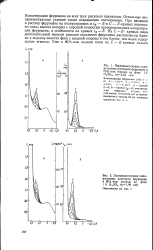
Методом переменнотоковой полярографии показано, что окисление ферроцена на капельном ртутном катоде в 60 - 96 % - ном этаноле протекает обратимо. На это указывает наличие пиков на кривых активной и реактивной составляющих переменного тока, совпадение потенциалов пиков, близость ширины полупиков к 88 мв и равенство высот пиков. Область адсорбции ферроцена с анодной стороны ограничена потенциалом окисления ферроцена, а с катодной - слабо выраженным пиком десорбции. [20]
При переходе от чисто водного раствора к этаноловому величины ЕЙ становятся более положительными приблизительно на 200 же. Волны восстановления катиона феррициния и окисления ферроцена в этаноле очень близки к потенциалу начала анодного растворения ртути. При любом составе растворителя величины Е восстановления катиона феррициния и окисления ферроцена практически совпадают ( рис. 6), что удовлетворяет критериям обратимости электродного процесса. [21]
Электрохимическое окисление ферроцена приводит к феррицениевому иону, а при электрохимическом восстановлении кислорода генерируется супероксид-ион. Оба этих ион-радикала можно получить в одном растворе, подавая на электрод переменные импульсы, соответствующие окислению ферроцена и восстановлению кислорода. [22]
Следовало ожидать, что при переходе от ферроцена к феррициний-ка-тиопу способность к ароматическому замещению существенно изменится. Свойства феррициииетшх солей изучены слабо. С другой стороны, аршшрование ферроцена солями арилдиазония [1, 13, 24, 25], так же как и конденсация ферроцена с альдегидами [14, 21, 22], сопровождается окислением ферроцена до феррициний-катиона, роль которого в описанных реакциях пока не выяснена. [23]
Восстановление катиона феррициния в водных растворах протекает с автоингибирова-нием. Замена воды этанолом устраняет ингибирование, так как при этом ослабляется адсорбция продукта электродного процесса - ферроцена - на ртути. Наблюдается параллелизм между ослаблением ингибирования и ростом растворимости ферроцена в водно-этаноловых смесях. Предельный ток окисления ферроцена в интервале 60 - 100 % этанола растет в соответствии с уменьшением вязкости среды. Зависимость предельного тока восстановления катиона феррициния от состава растворителя обусловлена изменением не только вязкости среды, но и сольватацией катиона феррициния. От состава растворителя сильно зависят также величины Е12, что имеет отношение к использованию системы ферроцен - феррициний как стандарта при сопоставлении нормальных потенциалов, измеренных в разных растворителях. [24]
Ферроцен [31] также восстанавливает ванадий ( IV) до ванадия ( III), но фон должен быть водно-спиртовым, содержащим обязательно фосфорную, серную или соляную кислоту. Спирт может быть любой - метиловый, пропиловый, можно пользоваться и муравьиной и уксусной кислотами, ацетонитрилом, ацетоном. Титруют по току окисления ферроцена на платиновом или графитовом электроде. Определению мешает железо ( III), которое надо удалять экстракцией. Это обстоятельство, равно как и необходимость пользоваться органическими растворителями, значительно снижает практическую ценность метода для производственных лабораторий. [25]
 |
Вольтамперограммы 1 - 10 3 моль / л раствора ферроцена. [26] |
Из (10.27) следует, что Ш0 не зависит от расположения электрода сравнения и определяется только сопротивлением раствора вблизи ультрамикроэлектрода. Этот результат справедлив и для других ультрамикроэлектродов. Расчеты показывают, что в тех случаях, когда ток достигает предельного значения, омические потери не зависят от геометрии электрода. На рис. 10.6 приведены вольтамперограммы окисления ферроцена в ацетонитриле на платиновом дисковом ультрамикроэлектроде. [27]
Концентрации ферроцена на всех трех рисунках одинаковы. При введении в раствор ферроцена на полярограммах и iR - Е - и С - - кривых возникают пики, высота которых с хорошей точностью пропорциональна концентрации ферроцена, в особенности на кривых iR - E. На С - Е - кривых пики дополнительной емкости реакции окисления ферроцена расположены близко к подъему емкости фона с анодной стороны и тем ближе, чем выше содержание этанола. [29]
Следует заметить, что во всех случаях, когда реагенты не содержат групп СОСН3, CN и С1, в реакционную среду добавляется алюмин иевая пыль, как это делает в своей реакции Е. О. Фишер, в отношении 1: 1 к соединению ферроцена. Это мешает нежелательному окислению ферроцена в феррициний-катион, что легко происходит под действием хлористого алюминия. Что касается феррициний-катиона, он в этой реакции не обменивает лиганда. Группы СОСН3 и CN восстанавливаются под действием А1 / А1С13, однако именно в случае этих групп применение алюминиевой пыли и не нужно, так как заместители - акцепторы электронов препятствуют окислению ферроцена. [30]
Страницы: 1 2 3