Окисление - элемент
Cтраница 1
Окисление элемента сопряжено с отдачей электронов атомом или ионом этого элемента. [1]
Окисление элемента сопровождается повышением его положительной или потерей отрицательной валентности, а восстановление - уменьшением положительной или приобретением отрицательной. Как известно, атом, присоединяя электроны, становится отрицательно заряженным ионом. Атом, теряя электроны, превращается в положительно заряженный ион. [2]
Окисление элемента сопровождается увеличением его степени окисления, а восстановление - уменьшением. [3]
Произведя окисление элемента, который входит в состав соединения в виде отрицательно заряженных атомов, можно получить эти атомы в нейтральном состоянии. Если атомы выделяются в среде, которая не растворяет их, они начнут соединяться в агрегаты, что приводит при наличии стабилизатора к образованию коллоидной системы. [4]
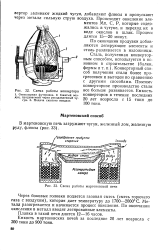 |
Схема работы конвертора.| Схема работы мартеновской печи. [5] |
Происходит окисление элементов Мп, С, Р, которые содержались в чугуне, и переход их в виде окислов в шлак. [6]
Степень окисления элементов - это электрический заряд, который может нести атом элемента в соединении при условии, что все связи ионные. [7]
Степени окисления элементов изменяются при окислительно-восстановительных реакциях. Изменение степеней окисления элементов происходит за счет перехода электронов или атомов от одних частиц к другим. [8]
Степень окисления элемента определяется формально по правилу 5 ( О-2) ( см. стр. [9]
Степень окисления элемента - понятие условное, однако оно весьма полезно. [10]
Степени окисления элементов изменяются при окислительно-восстановительных реакциях. Окислительно-восстановительные процессы характеризуются тем, что в них электроны переходят от одних частиц к другим. [11]
Степень окисления элемента часто не совпадает с его валентностью, которая определяется числом электронов, принимающих участие в перекрывании электронных облаков и образовании общего электронного облака связи. Так, в молекулах Н2 и НС1 каждый из атомов отдает по одному электрону на образование общего электронного облака связи и, следовательно, валентность водорода в обеих молекулах одинакова. Степени же окисления его различны. В молекуле Н2 максимальная плотность облака связи сосредоточена на равном расстоянии от ядер обоих атомов, поскольку оба они равноценны. Поэтому атомы сохраняют свой электронейтральный характер и степень окисления их рав на нулю. [12]
Полнота окисления элементов зависит не только от их концентрации в металле, но и от концентрации их окислов в шлаке, а также от того - в свободном или в связанном виде находятся они в шлаке. [13]
Степень окисления элемента в его высшем оксиде ( за исключением фтора и большинства элементов VIIIB группы) определяется суммарным числом электронов, находящихся во внешнем слое и в незаполненном предвнешнем d - подслое его атомов. [14]
Степень окисления элемента в одном из его промежуточных оксидов, как правило, определяется числом одиночных ( холостых) электронов, имеющихся в орбиталях его атомов. [15]
Страницы: 1 2 3 4