Электрохимическое окисление
Cтраница 1
Электрохимическое окисление в отличие от химического, по-видимому, не способно активировать металл ни на какой стадии. Более того, при определенных условиях блокирование электрохимически посаженным кислородом уже очень малой доли поверхности способно привести к резкому торможению ионизации металлических атомов. [1]
Электрохимическое окисление осуществляют в электролизер; с параллельно расположенными электродами, к которым подв дится постоянный ток. Для снижения омического сопротивлею в электролизеры добавляют сильный электролит, обычно хлор стый натрий. [3]
 |
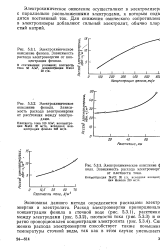
Технологическая схема установки электрохимического окисления циансодержащих сточных вод. [4] |
Электрохимическое окисление применяют для очистки сточных вод гальванических процессов, содержащих простые цианиды ( КСС1, NaCCl) или комплексные цианиды цинка, меди, железа и других металлов. Электрохимическое окисление осуществляют в электролизерах ( обычно прямоугольной формы) непрерывного или периодического действия. На аноде происходит окисление цианидов в малотоксичные и нетоксичные продукты ( цианаты, карбонаты, диоксид углерода, азот), а на катоде - разряд ионов водорода с образованием газообразного водорода и разряд ионов меди, цинка, кадмия, образующихся при диссоциации комплексных анионов с содержанием CN-группы. [5]
Электрохимическое окисление обычно осуществляют в электролизере без диафрагмы, т.е. не разделяя анодное и катодное пространства; обе стадии процесса - образование гипохлорита и окисление его до хлората - протекают параллельно. Предложены варианты, предусматривающие частичное разделение этих двух процессов, с вынесением процесса образования хлората в основном в реактор, расположенный вне электролизера. [6]
Электрохимическое окисление и восстановление органических соединений как метод синтеза применяется в меньшей степени, тогда как полярографические исследования многих органических соединений на капельном ртутном электроде проводятся уже давно. Некоторые электродные реакции органических соединений были известны еще Фарадею. [7]
Электрохимическое окисление m - ксиленола при применении анода из перекиси свинца в среде 2 N серной кислоты при 70 и плотности тока 0 0071 А / см2 ведет к образованию m - ксиленолхинона и значительного количества смолоподобных веществ. [8]
Электрохимическое окисление является одной из стадий процесса. [9]
Электрохимическое окисление позволяет превратить на аноде сульфат двухвалентного марганца в сульфат трехвалентного. [10]
Электрохимическое окисление в определенных условиях ( неводный растворитель, отсутствие нуклеофильных примесей) может происходить путем отрывп одного электрона. Ei / t в широких рядах соединений [54- 56], безусловно поддерживает гипотезу о том, что анодная реакция включает первоначальное образование катион-радикала, однако ФЭ-спектр содержит гораздо больше информации, ценной для понимания электрохимических превращений. Прежде всего, вместе с величиной ПИХ ФЭС дает возможность также установить и область локализации положительного заряда в данном катион-радикале, получаемом при выбивании верхнего электрона, а эта информация может служить основой для интерпретации дальней ших превращений катион-радикала. [11]
Электрохимическое окисление проведено в ацетонитриле на платиновом аноде. [12]
Электрохимическое окисление сопровождается потерей электронов, а затем удалением протонов, если такая возможность имеется. [13]
Электрохимическое окисление изучено мало. Однако фенил - и 2-нитрофенилтиоцианаты образуют только смолы. [14]
Электрохимическое окисление, по-видимому, не имеет особых преимуществ ни для лабораторной, ни для промышленной практики. [15]
Страницы: 1 2 3 4