Кривое окисление
Cтраница 3
На рис. 60 показан параболический характер кривых окисления. [31]
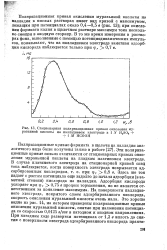 |
Стационарная поляризационная кривая окисления муравьиной кислоты на палладиевом электроде в 1 N H3S04 1 М НСООН. [32] |
Эти поляризационные кривые сильно отличаются от стационарных кривых окисления муравьиной кислоты на гладком платиновом электроде. Здесь же ток падает с ростом потенциала еще задолго до начала адсорбции ( в заметной степени) кислорода на палладии. Адсорбция кислорода ускоряет при фг 0 75 в процесс торможения, но не является ответственным за появление максимума. На поверхности палладие-вого электрода, покрытого слоем адсорбированного кислорода, скорость окисления муравьиной кислоты очень мала. Это хорошо видно из рис. 14, на котором приведены поляризационные кривые окисления муравьиной кислоты, снятые при наложении потенциала со скоростью 0 0125 в / сек в катодном и анодном направлениях. [33]
В качестве примера на рис. 3.10 приведены экспериментальные кривые окисления магния. [34]
 |
Зависимость свойств изоляционных масел от температуры. [35] |
При разработке нового масла или при оценке масел различных типов строят кривые окисления, полученные в течение стандартизованного периода испытания, получая характеристику изменения свойств масла во времени. Зависимости окисления и диэлектрических потерь от времени испытания имеют одну и ту же тенденцию. Неокисляющиеся углеводороды вызывают небольшие диэлектрические потери, а молекулы окисленных продуктов, образующиеся вследствие конденсации, являются причиной резкого роста диэлектрических потерь. [36]
Ценные сведения о природе пассивирующих пленок могут быть получены при сопоставлении потенциостатических кривых окисления вольфрама с электрохимическим поведением известных его окислов. Поэтому были синтезированы окислы вольфрама: WO2, WjOs, WO2 7s, WO2 8s, WO3 - и получены для них анодные поляризационные кривые. [37]
Реакция начинается сразу после впуска смеси в сосуд, причем кинетическая кривая АР - t имеет сложный характер, напоминая соответствующие кривые окисления бутена-2 при Т 209 С. [38]
Мак-Адам и Гейл [705], измерявшие интерференционным методом толщину пленок, образующихся на кремнии при 500 - 950 С, установили, что кривые окисления являются параболами. Бродский и Кубиччиотти [ 267, изучавшие особенности окисления кремния в температурном интервале 950 - 1160 С, обнаружили, что при 1000 - 1050 С экспериментальные результаты лучше выражаются не параболической закономерностью, а логарифмической. [39]
Из экспериментальных данных ( табл. 14) видно что в интервале температур 80 - 100 С при акустическом воздействий окисление меркаптидов до дисульфида протекает более интенсивно, хотя при низких температурах характер кривых окисления остается неизменным. [40]
В то время как карбиды Сг3С2 и TiC начинают окисляться только при 800 - 900 С, причем скорость их окисления описывается логарифмическим законом, карбиды Мо2С и WC заметно окисляются уже при 500 - 600 С и кривые окисления описываются зависимостями, близкими к линейным. [41]
Покрытие, полученное гальваническим методом, на первых этапах окисления защищает образец более надежно, чем покрытие, полученное химическим никелированием ( привес образца меньше, кривая идет ниже), но угол наклона кривой окисления к оси абсцисс значительно больше, чем у кривых окисления химического никеля. [42]
Начальная скорость окисления часто имеет очень небольшое отношение к разрушению в течение длительного периода. Кривые окисления различных нихромовых проволок при 1100, по Утида и Саито5, воспроизведенные на фиг. [43]
Форма кривых окисления показывает, что в разбавленных растворах кислоты процесс окисления на ртутных электродах включает в себя окисление рения ( - 1) до рения ( I) при - 0 50 в, рения ( I) до рения ( II) при - 0 27 в и рения ( II) до рения ( III) при - 0 02 в. Бок и Хакштейн [5] показали, что в разбавленных растворах серной кислоты восстановление рения до металла является неполным. [44]
Форма кривых окисления показывает, что в разбавленных растворах кислоты процесс окисления на ртутных электродах включаете себя окисление рения ( - 1) до рения ( I) при - 0 50 в, рения ( I) до рения ( II) при - 0 27 в и рения ( II) до рения ( III) при - 0 02 в. Бок и Хакштейн [5] показали, что в разбавленных растворах серной кислоты восстановление рения До металла является неполным. [45]
Страницы: 1 2 3 4 5