Окись - щелочноземельный металл
Cтраница 1
Окиси щелочноземельных металлов, непосредственно соединяясь с водой, дают гидроокиси, растворимость которых от Са к Ва увеличивается. Гидроокиси магния и бериллия в воде плохо растворимы, а потому их получают из солей обменными реакциями со щелочами. [1]
Гидраты окисей щелочноземельных металлов растворяются в воде довольно хорошо и являются сильными основаниями. Усиление основного характера и параллельно с этим увеличение растворимости в воде возрастают у них в направлении от гидрата окиси кальция к гидрату окиси бария. [2]
Гидраты окисей щелочноземельных металлов сравнительно хорошо растворимы в воде. Растворение в воде гидратов окисей щелочноземельных металлов типа Э ( ОН) 2, а также моногидрата кальция Са ( ОН) а - Н2О идет с выделением теплоты, тогда как Sr ( OH) 2 8НаО и Ва ( ОН) 2 8Н2О растворяются в ней с поглощением теплоты. Отсюда, с повышением температуры растворимость Са ( ОН) 2 - Н20 в воде понижается, а растворимость Sr ( OH) 2 - 8H3O и Ва ( ОН) 2 - 8Н2О повышается. [3]
При взаимодействии окисей щелочноземельных металлов и их гидратов с кислотами образуются соответствующие соли. В воде хорошо растворимы соли щелочноземельных металлов, в состав которых входят анионы СР, Вг -, 1 - и NO - Г, и плохо растворяются соли этих металлов с анионами СО. [4]
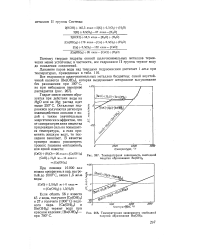 |
Температурная зависимость свободной энергии образования Ве ( ОН2.| Температурная зависимость свободно и энергии образования Ва ( ОН2. [5] |
Поэтому твердые гидраты окисей щелочноземельных металлов термически менее устойчивы; в частности, все гидроокиси II группы теряют воду до плавления соединений. [6]
Франк и Каро - окиси щелочноземельных металлов или магния или могущие их дать соединения; Бредиг и Элод - соединения редких земель ( особенно дидима, лантана, церия), а также окислы Ti, Mo, урана и особенно ванадия, далее те же вещества в смесях с другими катализаторами, напр. [7]
В окончательном виде представляет собой слой окиси щелочноземельных металлов ( почти всегда применяется смешанный оксид, содержащий ВаО и SrO), нанесенный либо на поверхность металлической проволоки или ленты ( керна), накаливаемой током ( прямонакальные катоды), либо на керн, нагреваемый особым, изолированным от него подогревателем. Первой задачей является, таким образом, нанесение на металлический керн прочного, хорошо скрепленного с ним слоя оксида. Так как окислы щелочноземельных металлов на воздухе поглощают влагу и быстро разрыхляются, метод нанесения должен исключать продолжительное соприкосновение слоя оксида с воздухом. [8]
Предложены также аналогичные методы конденсации в присутствии гидратов окисей щелочноземельных металлов. Так, 1 моль фенола и 1 5 моля СНзО конденсируют в присутствии гидрата окиси щелочноземельного металла, затем нейтрализуют HaSOj и слегка подкисляют борной или молочной кислотой. После обезвоживания получают смолу, которая легко измельчается в порошок и которую можно прессовать при повышенной температуре. [9]
При сплавлении 1 5 - или 1 8-антрахинондисульфокислоты с окисями щелочноземельных металлов реакцию легко остановить па промежуточной ступени образования оке иантрахинонсульфо-кислоты. [10]
Если нерастворимые соли железистосинеродистоводо-родной кислоты обрабатывать едкими щелочами или гидратами окисей щелочноземельных металлов, то они превращаются в соответствующие растворимые щелочные или щелочноземельные ферронианиды. Разбавленная серная кислота реагирует с растворами ферроцианидов только при температуре, близкой к кипению, когда часть связанного циана освобождается в виде синильной кислоты. [11]
ZrOa, ThO2, окись урана; Франк и Каро - окиси щелочноземельных металлов или магния или могущие их дать соединения; Вредиг и Элод - соединения редких земель ( особенно дидима, лантана, церия), а также окислы Ti, Mo, урана и особенно ванадия, далее те же вещества п смесях с другими катализаторами, напр. [12]
 |
Микрофотография СаСОо. [13] |
Выше уже указывалось, что с химической стороны твердение заключается в перекристаллизации гидратов окисей щелочноземельных металлов и поверхностной их карбонизации. Однако, в доступной нам литературе мы не встречали данных относительно изучения процессов твердения гидроокисей элементов второй группы. [14]
Следовательно, шестым типом химических и физико-химических процессов твердения вяжущих веществ является реакция гидратации окиси щелочноземельного металла и процесс перекристаллизации геля гидрата окиси в кристаллический сросток. [15]
Страницы: 1 2 3 4