Окраска - реактив
Cтраница 2
Поглотительные сосуды для выхлопных газов отключаются немедленно после изменения в каждом из них окраски реактива. При отключении последнего сосуда записывается показание газовых часов, выражающее суммарный объем газа, прошедшего через все поглотительные сосуды. [16]
В результате образования осадка Cu ( CBHt N) 4 ( C104) 2 интенсивность окраски реактива уменьшается. Недостатками метода являются большая продолжительность анализа ( 40 час. [17]
Растворяют 2 мг препарата в 1 мл воды, прибавляют 1 каплю раствора брома ИР1; окраска реактива исчезает. [18]
Хотя ионы редких земель не реагируют с тороном в мине-ральнокислой среде, при значительной концентрации они могут вызвать некоторое изменение окраски реактива. Поэтому в их присутствии реакцию следует вести в более кислой среде. Торий может быть обнаружен в присутствии редких земель при соотношении 1: 2000 при концентрации Th 0 15 мг / мл и при прибавлении 20 - 25 капель соляной кислоты ( уд. [19]
К 2 мл функсинсернистой кислоты в пробирке добавляют 1 каплю масляного альдегида, осторожно встряхивают пробирку и наблюдают за изменением окраски реактива в течение 3 - 4 мин. [20]
К 2 мл функсинсернистой кислоты в пробирке добавляют 1 каплю масляного альдегида, осторожно встряхивают пробирку и наблюдают за изменением окраски реактива в течение 3 - 4 мин. [21]
При встряхивании бензольного раствора тиурамата меди с водным раствором соли ртути ( П) в интервале рН от I до 12 происходит ослабление оранжево-коричневой окраски реактива вследствие образования бесцветного комплекса со ртутью. [22]
Затем проба газа проходит через сосуды 3, где NO2 реагирует с индикаторным реактивом, образуя азокраситель. По интенсивности окраски индикаторного реактива, измеряемой фотоколориметром, определяют суммарную концентрацию оксидов азота. Ввод пробы производят медицинским шприцем. [23]
Низкокипящие меркаптаны взвешивают в стеклянных ампулах. Когда начнет появляться сине-зеленая окраска реактива, что свидетельствует о близком конце титрования, раствор прибавляют по каплям. Иногда во время титрования раствор мутнеет, но перед точкой эквивалентности он снова становится прозрачным. Большинство меркаптидов меди растворимо, но иногда, особенно при титровании меркаптанов с низким молекулярным весом, меркаптид меди выпадает в виде желтого осадка. Для лучшего наблюдения конца титрования целесообразно осветить колбу и поместить сзади нее белый экран. Одновременно проводят контрольный опыт, результат которого следует учесть при вычислении. [24]
Одной из самых распространенных реакций окисления моносахаридов является действие солей двухвалентной меди в щелочной среде - обычно реактивов Фелинга или Бенедикта. Реакция сопровождается изменением окраски реактива и выпадением в осадок закиси меди. В эту реакцию вступают моносахариды со свободной альдегидной или кетогруп-пой, которые поэтому и называются восстанавливающими. Аналогичный по характеру действия реактив Толленса ( аммиачный раствор солей серебра) применяется реже, так как он легко реагирует со многими органическими соединениями неуглеводной природы. Окислять альдегидную группу способны и некоторые органические соединения. Практическое применение нашли реакции моносахаридов с 3 5-динитросалициловой кислотой5 и с солями тетразолия в щелочной среде6, сопровождающиеся получением окрашенных соединений. [25]
Электрохимические детекторы регистрируют очень слабый ток, возникающий при взаимодействии хлора с электролитом. В колориметрических датчиках используются сигналы фотоэлемента, определяющего интенсивность окраски реактива, изменяющего цвет при взаимодействии с хлором. [26]
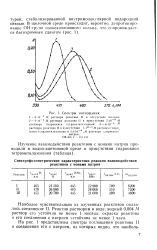 |
Спектры поглощения. [27] |
Реактив растворим в воде; водный 0 004 М раствор его устойчив не менее 1 месяца; окраска реактива и его соединения с натрием устойчива не менее 1 часа. [28]
Концентрацию окислов азота в продуктах горения [1] определяют линейно-колористическим и колориметрическим методами. Первый метод основан на измерении высоты столбика окрасившегося индикаторного порошка, а второй - на измерении интенсивности окраски индикаторного реактива. [29]
Определение гафния с арсеназо. Оксиазосоединения, содержащие арсоногруппу, осаждают в кислой среде некоторые металлы, в том числе и гафний, при этом происходит резкое изменение окраски реактива. Для фотометрического определения гафния и циркония применяют арсеназо I и арсеназо III. Наличие остатка мышьяковой кислоты в молекуле арсеназо увеличивает скорость протекания реакции. [30]
Страницы: 1 2 3 4