Оксид - медь
Cтраница 1
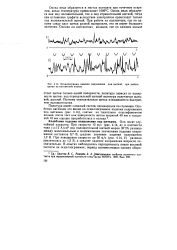 |
Осциллограмма падения напряжения под щеткой, при работе щетки на контактном кольце. [1] |
Оксид меди образуется в местах контакта при точечном искрении, когда температура превосходит 1000 С. Оксид меди образуется как под положительной, так и под отрицательной щеткой, тогда как отложение графита вследствие электролиза происходит только под положительной щеткой. При работе на коллекторе, где по одному следу идут щетки разной полярности, это не имеет большого значения. [2]
Оксид меди при этом восстанавливается до металлической меди. [3]
Оксид меди при этом восстанавливается до металлической меди, придавая ей красноватую окраску. Регенерацию ( активацию) оксида меди проводят после 2 - 3 анализов просасыванием воздуха через нагретую до 600 С кварцевую трубку; оксид меди после этого становится черным и более активным. [4]
Оксид меди ( I) Cu20 и оксид меди ( II) CuO растворяются в кислотах с образованием соответствующих солей. Оксид меди ( I) растворяется в растворах хлорида аммония и аммиака; оксид меди ( II) растворяется в растворах хлорида аммония и цианида калия. [5]
Оксид меди издавна использовался в качестве компонента красок для днищ судов и красителя в производстве стекла, керамики, эмалей, глазури для фарфора и искусственных драгоценных камней. Он также применяется для получения вискозы ( искусственного шелка), наряду с другими соединениями меди; для полировки оптических стекол; в качестве растворителя для хромово-железистых руд. Оксид меди содержится в плавильном флюсе для меди и бронзы, применяется в различных пиротехнических составах, в сельском хозяйстве - в качестве составляющих фунгицидов и инсектицидов. [6]
Оксид меди является катализатором процесса и при взаимодействии с SO2 превращается в CuSO4, который подвергается регенерации и возвращается в процесс. [7]
 |
Изменение / ti и цз феррита-граната в условиях магнитного резонанса. [8] |
Оксиды меди уменьшают пористость, а оксиды кобальта снижают константу анизотропии. Для длин волн А 5 см с целью снижения магнитных потерь от ферритов требуется малая намагниченность насыщения. [9]
Оксид меди, получаемый термическим разложением его нитрата, характеризуется небольшой удельной поверхностью ( 1 - 5 м2 / г); поэтому такой метод приготовления катализатора малопригоден. [10]
Оксид меди, имеющий прямую запрещенную зону шириной 1 95 эВ, вполне подходит для преобразования солнечного излучения. Элементы на основе Си2О обладают невысокой эффективностью, однако интерес к исследованию этого материала обусловлен чрезвычайно низкой стоимостью процесса его получения. Соответствующим образом ориентированные пленки Си2О могут быть выращены посредством нагрева медной подложки на воздухе при температуре 1050 С. Структура с барьером Шоттки образуется также и при нанесении на поверхность пленки Си2О слоя металла. [11]
Оксиды меди образуют легкоплавкие смеси с динасовыми, шамотными и высокоглиноземистыми изделиями. Смеси оксидов меди с хромитовыми и хромомагнезитовыми изделиями имеют высокую температуру плавления. [12]
Оксид меди ( 1) применяют в качестве наполнителя лаков и красок, для изготовления элементов купроксных выпрямителей. [13]
Оксид меди (), или закись меди, Си20 встречается в природе в виде минерала куприта. [14]
Оксид меди ( П) проявляет окислительные свойства. При нагревании с различными органическими веществами СиО окисляет их, превращая углерод в диоксид углерода, з водород - в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе орга-мческих веществ для определения содержания в них углерода з водорода. [15]
Страницы: 1 2 3 4