Оксид - щелочной щелочноземельный металл
Cтраница 3
Силикатное стекло обладает высокой прозрачностью, хорошей механической прочностью, стойкостью к воздействию химических реагентов, низкой теплопроводностью. Стекольная промышленность выпускает много сортов стекол, отличающихся свойствами и целевым назначением. Основу силикатных стекол составляет диоксид кремния SiC2 ( 65 - 75 %), в качестве добавок используют оксиды щелочных и щелочноземельных металлов ( Na2O, K O, CaO, MgO) и кислотные оксиды. [31]
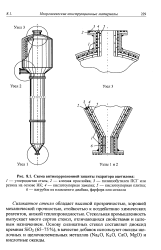 |
Схема антикоррозионной защиты гидратора ацетилена. [32] |
Силикатное стекло обладает высокой прозрачностью, хорошей механической прочностью, стойкостью к воздействию химических реагентов, низкой теплопроводностью. Стекольная промышленность выпускает много сортов стекол, отличающихся свойствами и целевым назначением. Основу силикатных стекол составляет диоксид кремния S1O2 ( 65 - 75 %), в качестве добавок используют оксиды щелочных и щелочноземельных металлов ( Na2O, K O, CaO, MgO) и кислотные оксиды. [33]
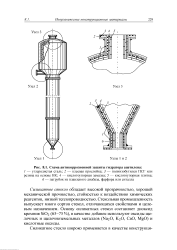 |
Схема антикоррозионной защиты гидратора ацетилена. [34] |
Силикатное стекло обладает высокой прозрачностью, хорошей механической прочностью, стойкостью к воздействию химических реагентов, низкой теплопроводностью. Стекольная промышленность выпускает много сортов стекол, отличающихся свойствами и целевым назначением. Основу силикатных стекол составляет диоксид кремния SIO2 ( 65 - 75 %), в качестве добавок используют оксиды щелочных и щелочноземельных металлов ( Na2O, K O, CaO, MgO) и кислотные оксиды. [35]
Активный оксид алюминия ( 7 - А12О3) нашел широкое применение в таких процессах нефтепереработки, как риформинг, гидроочистка, гидрокрекинг, где используют катализаторы, содержащие до 80 - 99 % 7 - А. Его получают прокаливанием гидроксида алюминия в тригидратной ( гиббсита, байерита, нордстран-дита) или в моногидратной ( диаспора, окристаллизованного бе-мита и псевдобемита) форме. Поверхность, объем и размер пор-получающегося оксида зависят от кристаллической модификации исходного гидроксида, остаточного содержания в нем воды, наличия оксидов щелочных и щелочноземельных металлов, а также от условий термической обработки. [36]
Причина реализации кубической координации, а не более предпочтительных антипризматической или додекаэдрической, носит чисто геометрический характер. Кубическая координация в CaF2 реализуется потому, что невозможно построить трехмерную структуру АХ2 с антипризматической или додекаэдрической координацией А и тетраэдрической координацией X. КЧ 12, ожидаемое при отношении радиусов, близком к 1, в структурах АХ и даже шире - в структурах АтХ - не наблюдается, хотя в комплексных галогенидах и оксидах щелочных и щелочноземельных металлов 12-вершинная координация встречается. Это также чисто геометрическая проблема, которая обсуждается далее. [37]
О структуре железосодержащих стекол данных мало. Методом гамма-резонансной спектроскопии показано, что железо в стеклообразных фазах присутствует в виде двух - и трехвалентных ионов в октаэдрической координации, и ионы железа и сурьмы образуют устойчивые структурные группировки. Ион Fe3 в четвертой координации образует тетраэдр [ Fe04 / 2 ] -, заряженный отрицательно, поэтому вероятность подхода к нему электрона незначительна. Оксиды щелочных и щелочноземельных металлов содействуют переходу Fe3 в четвертую координацию, и, таким образом, их присутствие в стекле вызывает уменьшение электронной проводимости. Эти выводы хорошо подтверждаются с помощью ЭПР. Резонансная полоса с - фактором, равным 2 0, обусловленная ионами Fe3 в свинцовосиликатных стеклах, значительно более интенсивна, чем в бариевосиликатных. [38]
При прокаливании осадков часто возможны реакции термического распада анализируемой соли на кислый и основной компоненты. Обычным примером может служить разложение карбонатов и сульфатов с образованием основного и кислотного оксидов. Поскольку температура, при которой разлагается вещество, зависит от кислотных и основных свойств образующихся оксидов, можно предсказывать некоторые важные характеристики стабильности соответствующих исходных соединений. Так, стабильность карбонатов и сульфатов щелочных металлов увеличивается соответственно с повышением основности оксидов щелочных и щелочноземельных металлов. Аналогичным образом термическая стойкость сульфата металла обычно выше, чем стойкость соответствующего карбоната, поскольку серный ангидрид проявляет более кислые свойства, чем диоксид углерода. Такого рода зависимости обычно соблюдаются, если не происходят более глубокие превращения при прокаливании осадка, например изменение степени окисления и др. При прокаливании могут происходить и другие кислотно-основные реакции, например реакции обмена или замещения. [39]
Белый, существует в двух полиморфных модификациях ( а-тетрагональная, р-тригональная) и в аморфной ( стекловидной) форме. Прокаленные а-модифи-кация и аморфная форма химически пассивны; приведенные ниже реакции относятся к р-модификации. Плохо реагирует с водой. Из раствора осаждается гидрат mGeO2 лН2О, весьма реакционноспособный. Проявляет амфотерные свойства; реагирует с кислотами, щелочами, оксидами щелочных и щелочноземельных металлов. [40]
Если связующая пара электронов окажется на равном расстоянии от обоих ядер, ковалентная связь считается неполярной. При смещении электронной пары в сторону атома, более склонного к их присоединению ( более электроотрицательного), связь становится полярной, и если это смещение выражено весьма резко, связь считается ионной. Примеры строго неполярных связей ( С-С, Н - Н, С1 - С1), полярных ( С - С1, Н - С1, Н - Вг), ионных ( Na - С1, К - Вг) показывают, что чем больше различие в природе соединяющихся атомов, тем более их связь является полярной и, наконец, ионной. Однако целиком ионных связей нет, так как атом, отдавая электрон, получает способность притягивать его обратно и, следовательно, отрицательный заряд в молекуле не строго локализован около другого, более электроотрицательного атома. Это ограничение ионного характера связи имеет существенное значение для оценки различных свойств соединений. Огромному большинству соединений свойственны связи различной степени полярности - слабополярные ( S - С1, С - О), более полярные Н - С1, Н - F. Ионные связи встречаются сравнительно редко ( в галидах и оксидах щелочных и щелочноземельных металлов), но и в этих случаях с вышеуказанным ограничением. [41]
Страницы: 1 2 3